SISTEMA PERIDICO PROPIEDADES PERIDICAS Son las que varan





- Slides: 8

SISTEMA PERIÓDICO

PROPIEDADES PERIÓDICAS Son las que varían de modo regular con el número atómico Z. Se relacionan con la situación de cada elemento en la tabla, o sea con la configuración electrónica de su última capa *Algunas son: . Radio atómico (volumen atómico). Radio iónico. Energía de ionización. Afinidad electrónica

Radio atómico *Representa la distancia que existe entre el núcleo y la capa de valencia (la más externa). *En los grupos, el radio atómico aumenta con Z, es decir hacia abajo Se añade una capa más *En los períodos disminuye al aumentar Z, hacia la derecha, debido a la atracción que ejerce el núcleo sobre los electrones de los orbitales más externos, disminuyendo así la distancia núcleoelectrón. aumenta

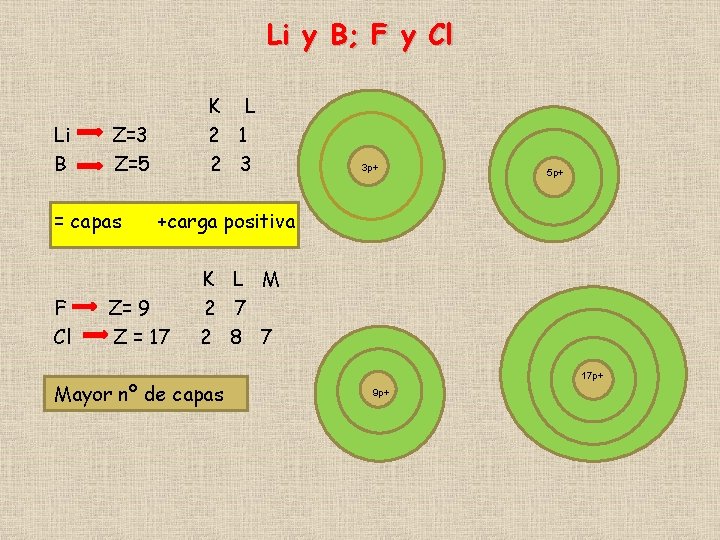
Li y B; F y Cl Li B Z=3 Z=5 = capas F Cl K L 2 1 2 3 3 p+ 5 p+ +carga positiva Z= 9 Z = 17 K L M 2 7 2 8 7 Mayor nº de capas 17 p+ 9 p+

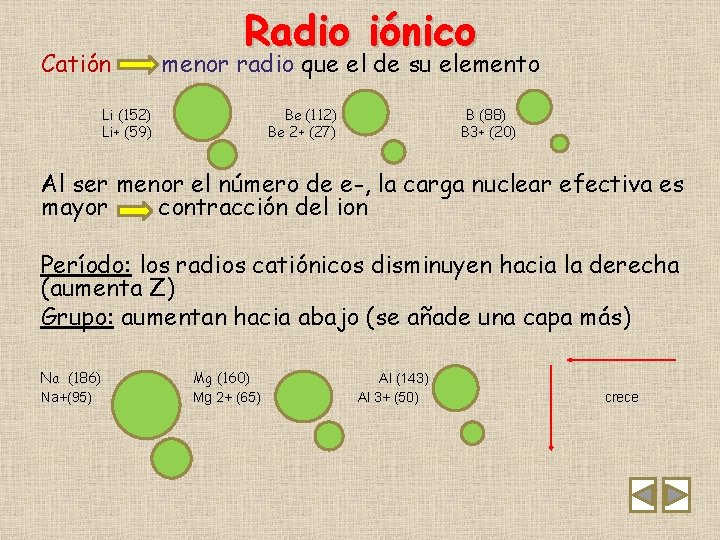
Catión Radio iónico menor radio que el de su elemento Li (152) Li+ (59) Be (112) Be 2+ (27) B (88) B 3+ (20) Al ser menor el número de e-, la carga nuclear efectiva es mayor contracción del ion Período: los radios catiónicos disminuyen hacia la derecha (aumenta Z) Grupo: aumentan hacia abajo (se añade una capa más) Na (186) Na+(95) Mg (160) Mg 2+ (65) Al (143) Al 3+ (50) crece

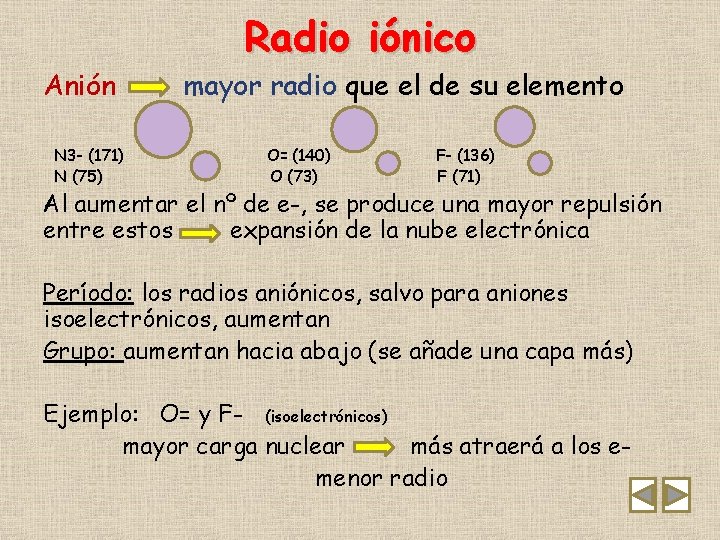
Anión N 3 - (171) N (75) Radio iónico mayor radio que el de su elemento O= (140) O (73) F- (136) F (71) Al aumentar el nº de e-, se produce una mayor repulsión entre estos expansión de la nube electrónica Período: los radios aniónicos, salvo para aniones isoelectrónicos, aumentan Grupo: aumentan hacia abajo (se añade una capa más) Ejemplo: O= y F- (isoelectrónicos) mayor carga nuclear más atraerá a los emenor radio

Energía de ionización o potencial de ionización Energía mínima necesaria para arrancar un e- de un átomo en fase gaseosa. EI o PI (k. J/mol o e. V/átomo) X (g) + PI X (g) + 1 e Período: PI aumenta con Z aumenta cuanto más atraído por el núcleo está el e- más energía habrá que suministrar para arrancarlo Grupo: PI disminuye al aumentar Z aumenta el nº de capas los e- externos están menos atraídos menos energía habrá que suministrar para arrancarlo

Afinidad electrónica o electroafinidad *Energía que libera un átomo en fase gaseosa cuando capta un e- convirtiéndose en un ion negativo. AE (k. J/mol, kcal/mol o e. V/átomo) X (g) + 1 e X (g) + AE *En cierto modo, es una propiedad inversa al PI Elementos que requieren mucha energía para arrancarles un e- serán también los que desprendan más energía al captar un e. Período: aumenta al aumentar Z Grupo: disminuye al aumentar Z aumenta