Relacin entre los nmeros cunticos configuracin electrnica y






- Slides: 10

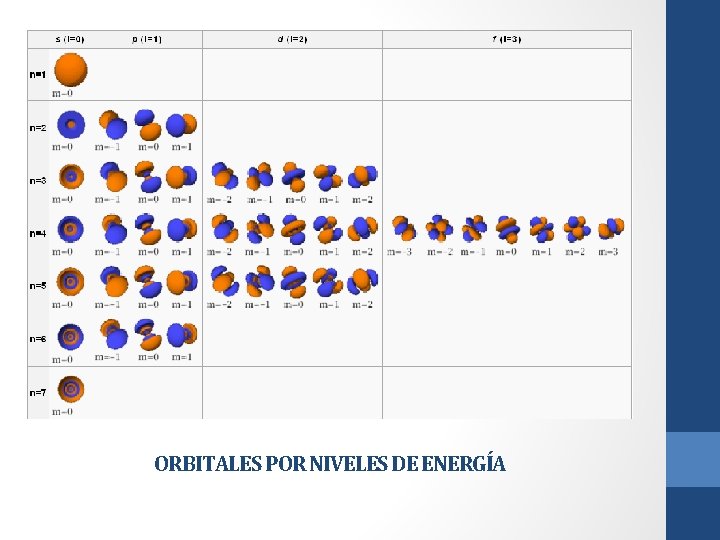
Relación entre los números cuánticos, configuración electrónica y estructura de la tabla periódica. • Como hemos explicado anteriormente mediante un cuadro sinóptico, la actual tabla periódica está ordenada según la Ley Periódica, en Grupos o familias, y períodos, así mismo hemos distribuido los electrones por niveles de energía. • Pero, ¿qué es la configuración electrónica? La configuración electrónica (o C. E) indica la posición de cada electrón dentro de la envoltura nuclear, indicando en el nivel energético en el que éste se encuentra y en que orbital. Cada electrón puede ser identificado específicamente gracias a sus cuatro números cuánticos, los cuales son: • Número Cuántico principal (n): Corresponde al nivel energético en donde se encuentra el electrón. Va desde 1 hacia arriba (1, 2, 3. . . ) • Número Cuántico secundario o azimutal (l): Corresponde al orbital en donde se encuentra el electrón. Se representa por s (0), p (1), d (2) y f (3). • Número Cuántico Magnético (m): Indica la orientación del orbital donde se encuentra el electrón. Va desde -l hasta l (incluyendo el 0). • Número Cuántico de Spin o Giro (s): Este número cuántico se define tradicionalmente como el giro que posee el electrón. Dos electrones con el mismo giro no pueden tener un mismo m (solo se permiten dos electrones por m y deben tener spines (giros) opuestos). Se identifican tradicionalmente como 1/2 y +1/2 o -1 y +1, en esta página web se utilizará la primera identificación (1/2 y +1/2).

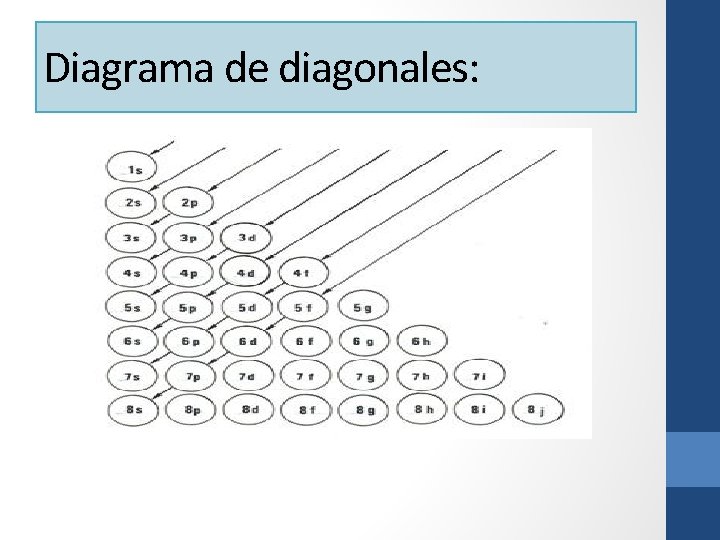
Ahora para poder seguir avanzando en la configuración electrónica debemos conocer primero unos ciertos principios que nos ayudarán a comprender mejor como se desarrolla este tema. Dichos principios son: • Principio de Aufbau o de la menor energía: Este principio nos indica que todos los electrones partirán "llenando" los orbitales de menor energía posible. Si el de menor energía está lleno, seguirán con el que le sigue en energía y así sucesivamente. • Principio de Hund o de la máxima multiplicidad: Este principio nos dice que en caso de que existan orbitales atómicos con la misma energía, los electrones se distribuirán equitativamente en cada uno y cuando todos tengan un electrón se empezaran a llenar con los que les falten. Por ejemplo, si se tiene tres orbitales con la misma energía (denominados orbitales degenerados), los electrones entrarán de tal manera que los primeros tres electrones entrarán uno en cada orbital, todos con el mismo spin. Cuando esto ocurre se dice que el orbital (los orbitales en este caso) se encuentra semi-lleno. Posteriormente, se completaran los orbitales con los electrones que hagan falta para este efecto. Esto se comprenderá de mejor manera más adelante, cuando se hagan algunos ejemplos. • Principio de exclusión de Pauli: Este principio nos dice que cada electrón posee una combinación única de 4 números cuánticos que lo personaliza. No es posible que existan dos electrones con los 4 números cuánticos iguales. Esto quiere decir, que solamente pueden existir dos electrones por orbital, ya que existen dos espines (+1/2 y -1/2).

Explicación: • Si se fijan arriba hablé de los orbitales degenerados o con energías iguales, pero: • ¿De dónde salen? • ¿Cómo se sabe cuántos orbitales degenerados existen y quién los determina? • Bueno la respuesta a estas preguntas las da el número cuántico magnético, ya que él es el encargado de indicarnos la orientación espacial de los orbitales. • Ahora les colocaré un ejemplo para quede mucho más claro.

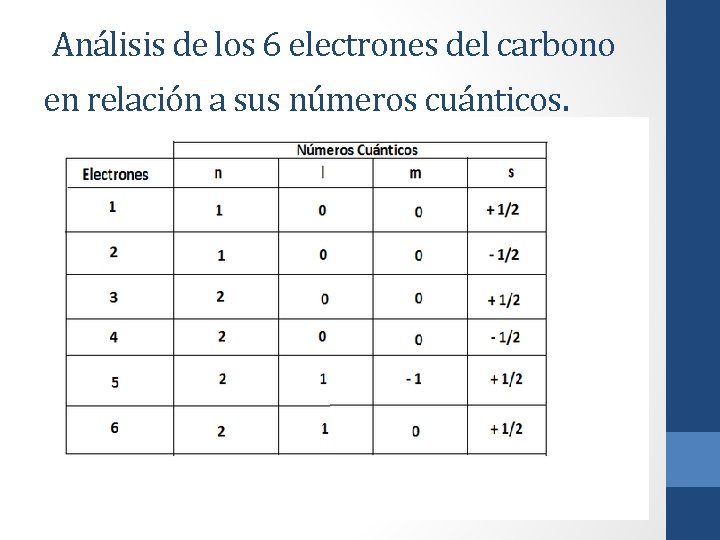
Análisis de los 6 electrones del carbono en relación a sus números cuánticos.

Argumento según Pauli, Auf. Bau y Hund. • Como se puede ver en la imagen de arriba, cada electrón esta individualmente identificado por ciertos números cuánticos, y no existen dos electrones que se repitan los mismos cuatros números (principio de exclusión), también se puede ver que los electrones 5 y 6 se encuentran en orbitales degenerados, debido a que la orientación de los orbitales es distinta (máxima multiplicidad). Según la tabla el primer electrón entró en el de menor energía, el segundo, lo llenó (Principio de Pauling) y el tercero se situó en el que le seguí en energía (Principio de Aufbau). Los niveles de energía de los orbitales, y los orbitales existentes en cada nivel energético se muestran en la Imagen 11. • Si uno se da cuenta, la tabla de arriba es algo engorrosa cuando un átomo tenga más electrones, por lo que se necesita un método más simplificado para escribir exactamente lo mismo, es ahí donde se crea la configuración electrónica, la que para el ejemplo que hemos puesto, sería como sigue: • 1 s 2 2 px 1 py 1 pz 0 • Nótese que, a pesar de que en el último orbital degenerado no existen electrones, de igual manera se anota. Es importante recalcar que tanto las letras x, y, z (estas letras indican la orientación espacial de los orbitales) que figuran abajo de los orbitales p, como así también el orden de llenado (primero x, luego y, para finalizar en z) es por convención, debido a que, como los tres orbitales poseen la misma energía da lo mismo si un electrón entra en x, y o z.

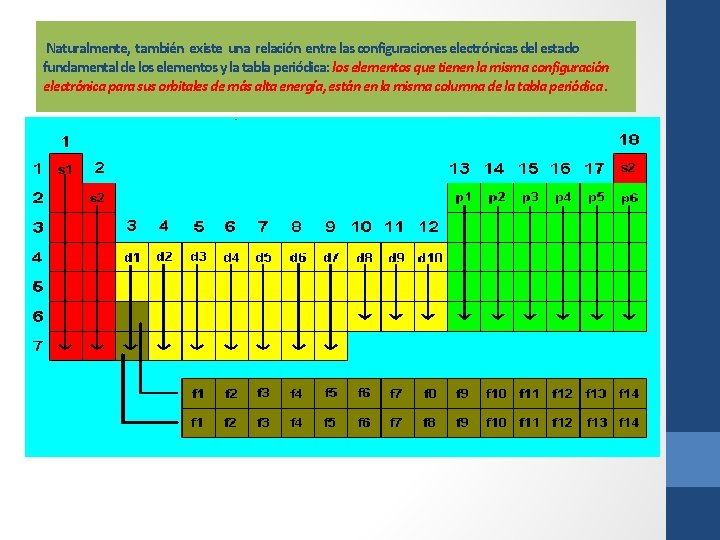
Naturalmente, también existe una relación entre las configuraciones electrónicas del estado fundamental de los elementos y la tabla periódica: los elementos que tienen la misma configuración electrónica para sus orbitales de más alta energía, están en la misma columna de la tabla periódica.

Diagrama de diagonales:



ORBITALES POR NIVELES DE ENERGÍA