Reakce alkan a cykloalkan VY32INOVACE527 Ing Jan Voek













- Slides: 15


Reakce alkanů a cykloalkanů. VY_32_INOVACE_5_2_7 Ing. Jan Voříšek

� Nasycené uhlovodíky jsou velmi málo reaktivní. � Disociační energie vazeb C-C a C-H jsou velmi vysoké a to vysvětluje, proč reakce alkanů často probíhají za vyšších teplot. �V nasycených uhlovodících jsou všechny vazby zcela nepolární nebo je polarita prakticky zanedbatelná. � Proto nejsou alkany náchylné k heterolytickému štěpení vazeb za vzniku iontů.

�V současné době se denně uskutečňuje řada chemických reakcí alkanů: � Zkusíte sami nějakou reakci vyjmenovat? - při hoření uhlovodíkových paliv s kyslíkem, při chemických procesech v ropných rafineriích, při výrobě sloučenin alkanů s halogeny atd. Všechny tyto reakce mají jedno společné: štěpení vazeb v alkanech je homolytická reakce.

� Pro nasycené uhlovodíky je charakteristickou reakcí radikálová substituce. � Jedná se o homolytickou reakci, kdy vznikají částice s nepárovými elektrony – radikály. � Vlastní průběh reakce si vysvětlíme na reakci alkanu s halogenem tzv. halogenaci. Konkrétně na reakci methanu s chlorem.

� Zdánlivě jednoduchá reakce CH 4 +Cl 2 CH 3 Cl + HCl je ve skutečnosti složitý děj, který probíhá ve třech fázích: 1. iniciace 2. propagace 3. terminace

�V první fázi tzv. iniciaci dochází k homolýze vazeb. Většinou se neštěpí vazby v molekule alkanu, ale v molekule činidla. �V našem případě se relativně slabá vazba Cl -Cl působením ultrafialového záření homolyticky štěpí na dva reaktivní atomy chloru. � Cl – Cl UV Cl + Cl

� Ve druhé fázi, tzv. propagaci reagují vzniklé radikály s molekulami alkanu za vzniku alkylových radikálů a halogenovodíků. H � H –C-H + H Cl H H –C H + H-Cl

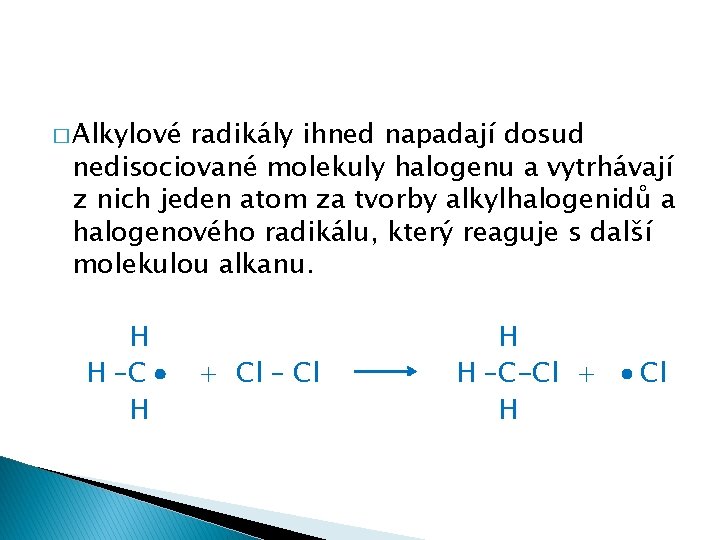
� Alkylové radikály ihned napadají dosud nedisociované molekuly halogenu a vytrhávají z nich jeden atom za tvorby alkylhalogenidů a halogenového radikálu, který reaguje s další molekulou alkanu. H H –C H + Cl – Cl H H –C-Cl + H Cl

� Ve třetí fázi terminaci dochází k ukončení celé řetězové reakce. Ukončení může proběhnout několika způsoby: � a) sloučení dvou stejných nebo různých radikálů � Cl + Cl H � H-C H + Cl Cl-Cl H H-C-Cl H

� b) Do reakční soustavy se přidá inhibitor, což je látka, která reaguje s volnými radikály za vzniku částic, které zabraňují další propagaci. � Inhibitorem radikálových halogenací uhlovodíků je např. kyslík. Ten se slučuje s alkylovým radikálem za vzniku málo reaktivního peroxyalkylového radikálu, který zablokuje propagaci. H H-C H + O 2 H H-C-O-O H

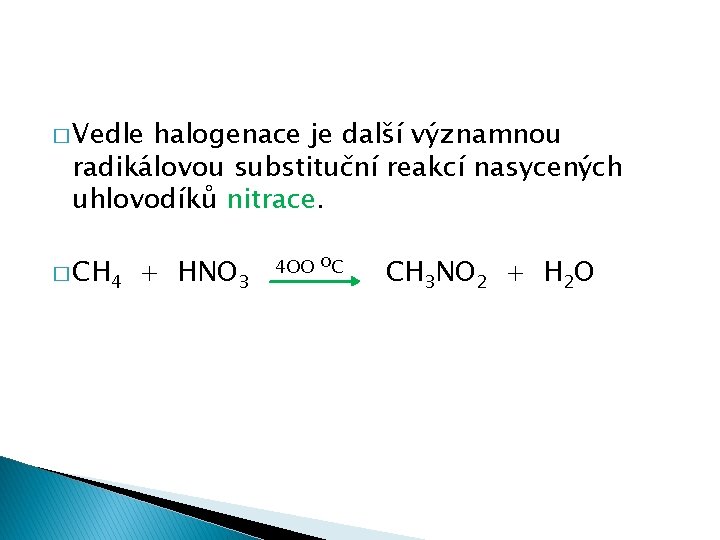
� Vedle halogenace je další významnou radikálovou substituční reakcí nasycených uhlovodíků nitrace. � CH 4 + HNO 3 4 OO o. C CH 3 NO 2 + H 2 O

� Dalším významným typem reakcí u alkanů jsou eliminační reakce. � Tyto probíhají při teplotách až 6 OO o. C nebo při nižších teplotách za přítomnosti katalyzátorů. � Při těchto reakcích vznikají nenasycené uhlovodíky. Protože se uvolňuje vodík, nazývá se reakce dehydrogenace. H H H-C - C-H H H ( Pt ) H H C=C H H + H 2

� Zdroj informací: Mc. MURRY, John. Organická chemie. Vydání první. Vydalo Vysoké učení technické v Brně – nakl. VUTIUM, Brno, 2007. Počet stran 1260. ISBN 978 -80 -2143291 -8 (VUT v Brně). � VACÍK, Jiří. Přehled středoškolské chemie. Třetí doplněné vydání. Vydalo SPN-pedagogické nakladatelství, a. s. , Praha, 1996. Počet stran 368. ISBN 80 -85937 -08 -5. � HONZA, Jaroslav, MAREČEK, Aleš. Chemie pro čtyřletá gymnázia. 2. díl. Druhé přepracované vydání. Vydalo Nakladatelství Olomouc, 1998. Počet stran 232. ISBN 80 -7182 -056 -3. �

� � � � � � Téma sady: Vzdělávací oblast: Vzdělávací obor: Tematický okruh: Studium uhlovodíků Člověk a příroda Chemie Organická chemie Autor: Ing. Jan Voříšek Rok vytvoření materiálu: 2012 Název materiálu: Reakce alkanů a cykloalkanů. Jazyk: čeština Očekávaný výstup: Žák rozliší a popíše jednotlivé typy reakcí alkanů a cykloalkanů. Klíčová slova: organická chemie, alkany, cykloalkany, iniciace, propagace, terminace, homolytická reakce. Druh učebního materiálu: prezentace s aktivizací žáka Cílová skupina: žák Stupeň a typ vzdělávání: gymnaziální vzdělávání Typická věková skupina: 16 -19 let Pokyny pro práci s materiálem: Prezentace je využitelná jako výklad učiva na dané téma.