Reakce alkan CH 4 Chemick reakce a dje







- Slides: 13


Reakce alkanů CH- 4 Chemické reakce a děje , DUM č. 8 sexta osmiletého studia Mgr. Radovan Sloup Gymnázium Sušice Tento materiál byl vytvořen v rámci projektu Gymnázium Sušice – Brána vzdělávání II

Reakce alkanů Reaktivita alkanů je dána vlastnostmi vazeb v molekulách: Vazby v molekulách alkanů jsou pouze jednoduché – vazby sigma, nepolární a stabilní. Štěpí se pouze homolyticky za vzniku volných radikálů s nepárovým elektronem. Reakce musí být proto iniciována zářením a změnou podmínek. Alkany nereagují s anorganickými látkami za normální teploty, tlaku a bez katalyzátorů. Vznik radikálů umožňuje například ionizující nebo UV záření. Tyto faktory zapisujeme nad šipku. CH 4 + Cl 2 UV CH 3 Cl + HCl

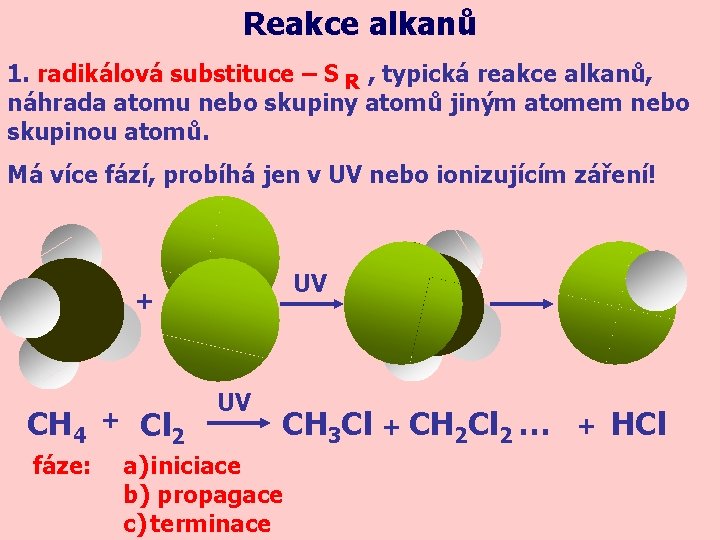
Reakce alkanů 1. radikálová substituce – S R , typická reakce alkanů, náhrada atomu nebo skupiny atomů jiným atomem nebo skupinou atomů. Má více fází, probíhá jen v UV nebo ionizujícím záření! UV + CH 4 fáze: + Cl 2 UV CH 3 Cl + CH 2 Cl 2 … a) iniciace b) propagace c) terminace + HCl

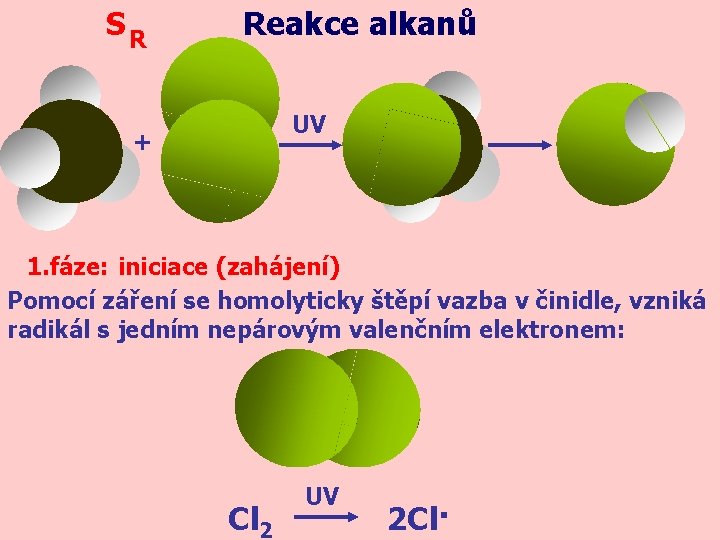
SR Reakce alkanů UV + 1. fáze: iniciace (zahájení) Pomocí záření se homolyticky štěpí vazba v činidle, vzniká radikál s jedním nepárovým valenčním elektronem: Cl 2 UV 2 Cl·

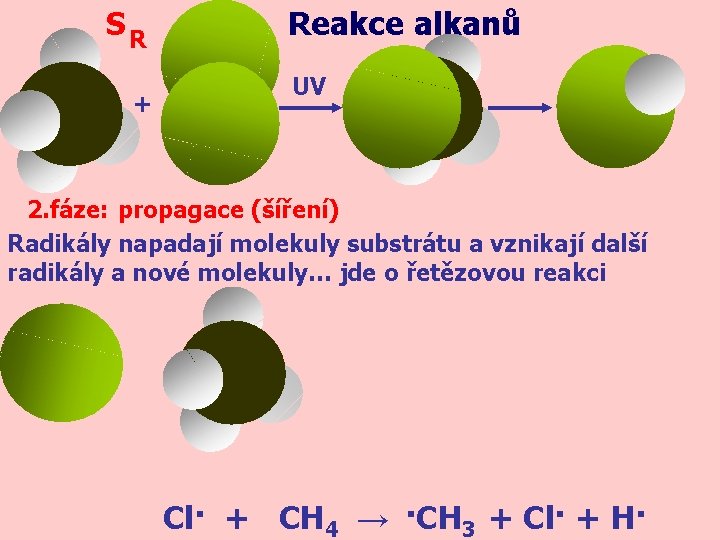
SR + Reakce alkanů UV 2. fáze: propagace (šíření) Radikály napadají molekuly substrátu a vznikají další radikály a nové molekuly… jde o řetězovou reakci Cl· + CH 4 → ·CH 3 + Cl· + H·

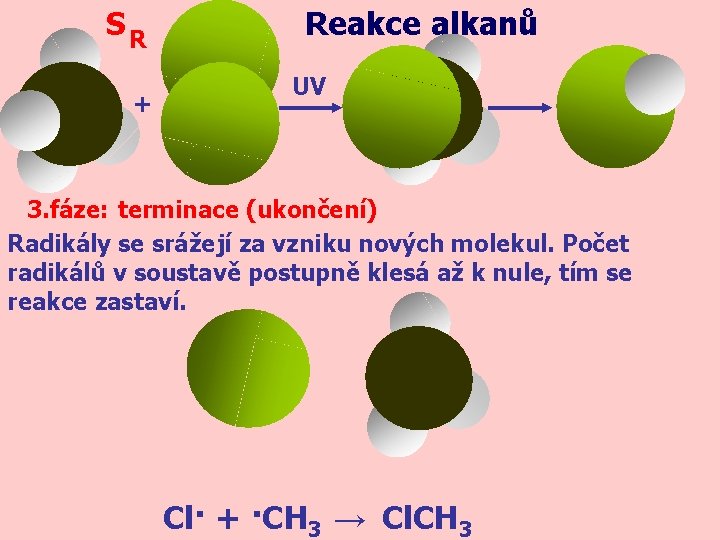
SR + Reakce alkanů UV 3. fáze: terminace (ukončení) Radikály se srážejí za vzniku nových molekul. Počet radikálů v soustavě postupně klesá až k nule, tím se reakce zastaví. Cl· + ·CH 3 → Cl. CH 3

eliminace: Reakce alkanů 2. eliminace, reakce alkanů, kdy se zvyšuje násobnost vazby (při současném odštěpení molekul(y) vodíku). Několik možností, např. termolýza nebo dehydrogenace a) termolýza, rozklad za vysoké teploty (asi 500 °C), kdy dochází ke štěpení dlouhých řetězců uhlíků na dva přibližně stejné řetězce. Vzniká alkan a alken: CH 3 CH 2 CH 2 CH 2 CH 3 500 °C CH 3 CH 2 CH 2 CH 3 + CH 3 CH 2 CH=CHCH 2 CH 3 Termolýza musí probíhat za nepřístupu vzduchu, jinak dojde k oxidaci a uhlovodík shoří!

eliminace: Reakce alkanů b) dehydrogenace, rozklad za vysoké teploty (asi 300 °C), v přítomnosti katalyzátoru, kdy dochází ke odštěpení vodíku/ů a zvýšení násobnosti vazby. Vzniká alken: CH 3 CH 2 CH 3 Ni 500 °C CH 2=CH-CH=CH 2 + 2 H 2 Katalyzátorem může být také platina. Reakce má obrovský význam v chemickém průmyslu.

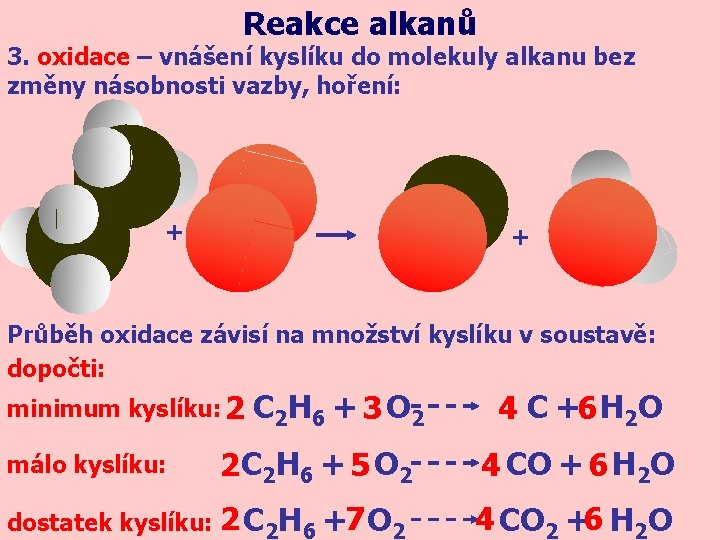
Reakce alkanů 3. oxidace – vnášení kyslíku do molekuly alkanu bez změny násobnosti vazby, hoření: + + Průběh oxidace závisí na množství kyslíku v soustavě: dopočti: minimum kyslíku: 2 C 2 H 6 + 3 O 2 4 C +6 H 2 O 2 C 2 H 6 + 5 O 2 4 CO + 6 H 2 O dostatek kyslíku: 2 C 2 H 6 +7 O 2 4 CO 2 +6 H 2 O málo kyslíku:

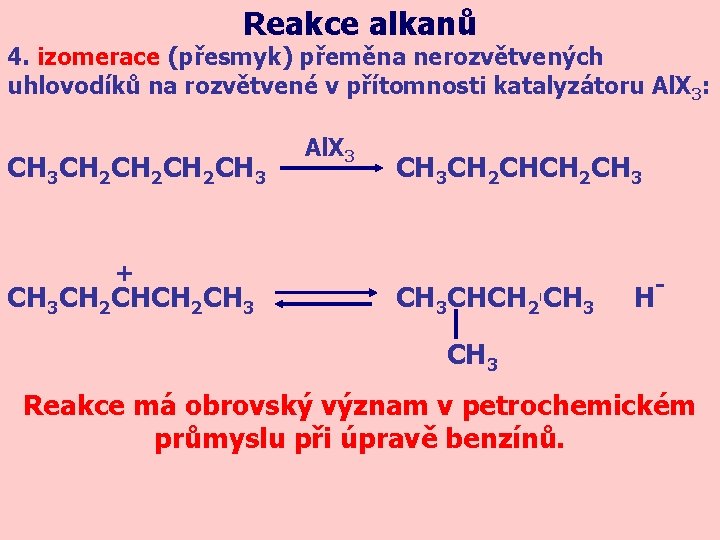
Reakce alkanů 4. izomerace (přesmyk) přeměna nerozvětvených uhlovodíků na rozvětvené v přítomnosti katalyzátoru Al. X 3: CH 3 CH 2 CH 2 CH 3 + CH 3 CH 2 CH 3 Al. X 3 CH 3 CH 2 CH 3 + CH 23 CH 3 CHCH 2 CH H - CH 3 Reakce má obrovský význam v petrochemickém průmyslu při úpravě benzínů.

podle předchozího přehledu doplň za 5 minut produkty: CH 3 – CH 2 – CH 3 + Br 2 (UV) → H 2 , CH 3 – CHBr – CH 2 Br CH 3 – CHBr – CH 3 , CH 3 – CBr 2 – CH 2 Br , CH 3 – CH 2 Br CH 3 – CBr 2 – CBr 3 , CH 3 – CBr 2 – CHBr 2 , CBr 3 – CH 2 Br CBr 3 – CH 2 – CBr 3 , CHBr 2 – CHBr 2 CBr 3 – CBr 2 – CBr 3…

REAKCE ALKANŮ Vytvořeno v rámci projektu Gymnázium Sušice - Brána vzdělávání II Autor: Mgr. Radovan Sloup, Gymnázium Sušice Předmět: Chemie (Chemické reakce a děje) Třída: sexta osmiletého studia Označení: VY_32_INOVACE_Ch-4_08 Datum vytvoření: ČERVEN 2013 Anotace a metodické poznámky Reakce alkanů je vhodné probrat podrobněji, protože se tak při jednom zopakují témata organických reakcí a jejich průběhu. Z toho důvodu je v úvodu každého typu reakce alkanů zmíněn i její základní mechanismus a charakteristika. Mezi základní reakce alkanů patří radikálová substituce, eliminace, oxidace a izomerace. Zvládnutí organické chemie spočívá v pochopení mechanismů základních reakcích uhlovodíků. Tato prezentace poskytuje přehled základních reakcí alkanů s jejich konkrétními příklady. V závěru prezentace je jednoduché cvičení k orientaci v reakcích. Prezentaci je možné doplnit dalšími reakcemi. Použité materiály: Honza, J. ; Mareček, A. ; Chemie pro čtyřletá gymnázia (2. díl). Brno: Da. Ta. Print, 2000; ISBN 80 -7182 -141 -1 Pacák, J. ; Chemie pro 2. ročník gymnázií. Praha: SPN, 1985 Obrázky, animace a schémata jsou dílem autora prezentace. Vše je vytvořeno pomocí nástrojů Power Point 2003, Chem. Sketch 11. 01 Materiály jsou určeny pro bezplatné používání pro potřeby výuky a vzdělávání na všech typech škol a školských zařízení. Jakékoliv další využití podléhá autorskému zákonu.