POTENSIOMETRI Edi Nasra S Si M Si SEL

















![Selektifitas Membran [A]E dan [I]E adalah konsentrasi analit dan pengganggu yang memberikan nilai potensial Selektifitas Membran [A]E dan [I]E adalah konsentrasi analit dan pengganggu yang memberikan nilai potensial](https://slidetodoc.com/presentation_image_h/32efa54eafd0b6a56c9fd8a633301c7b/image-21.jpg)







- Slides: 33

POTENSIOMETRI Edi Nasra, S. Si. , M. Si

SEL VOLTA

Potensial Sel

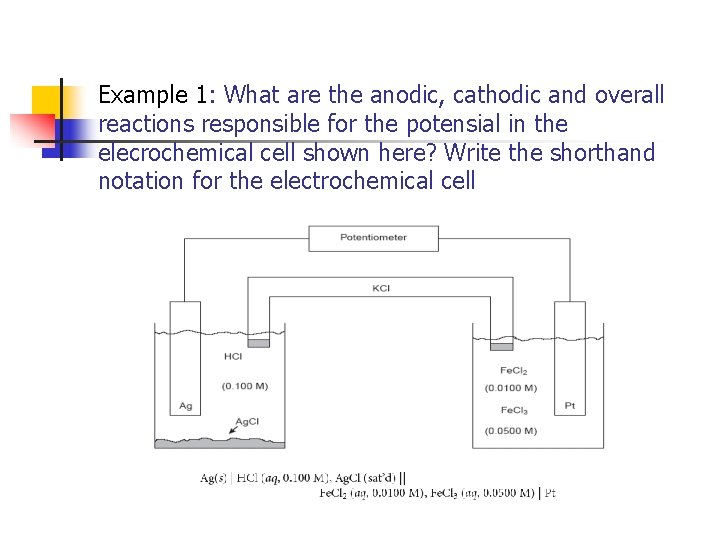
Example 1: What are the anodic, cathodic and overall reactions responsible for the potensial in the elecrochemical cell shown here? Write the shorthand notation for the electrochemical cell

Example 2: what is the potential of the electrochemical cell shown in example 1 (Eo Fe 3+/Fe 2+ = +0. 771 V ; Eo Ag. Cl/Ag = +0. 2223 V

Example 3: what is the concentration of Fe 3+ in an electrochemical cell similar to that shown in example 1 if concentration of HCl in the left-hand cell is 1. 0 M, the concentration of Fe. Cl 2 in the right-hand cell is 0. 0151 M and the measured potential is +0. 546 V

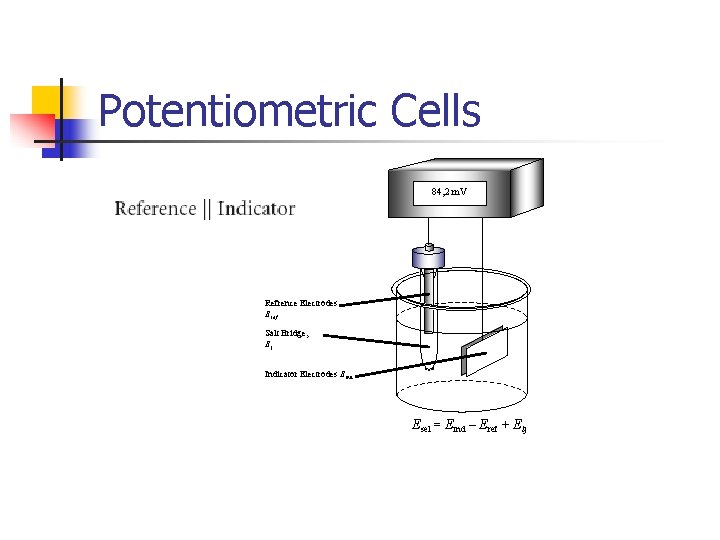
Potentiometric Cells 84, 2 m. V Refrence Electrodes Eref Salt Bridge, Ej Indicator Electrodes Eind Esel = Eind – Eref + Elj

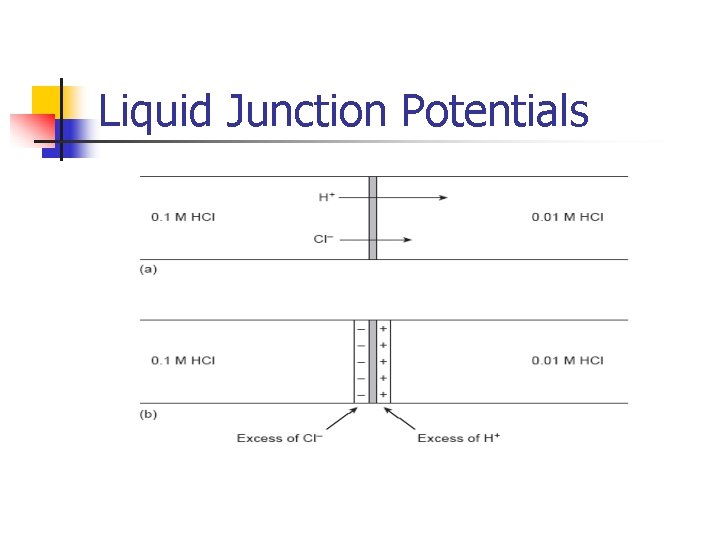
Liquid Junction Potentials

Elektroda Pembanding Elektroda yang mempunyai harga potensial tetap dan konstan dan tidak dipengaruhi konsentrasi analit dalam larutan

Elektroda Hidrogen Standar

Elektroda Kalomel Besarnya potensial sel: • jika digunakan KCl jenuh + 0. 2440 V • jika [KCl] 3. 5 M maka E = +0. 2500 V • jika [KCl] 0. 1 M maka E = +0. 3356 V

Elektroda Ag/Ag. Cl Besarnya potensial: • jika digunakan KCl jenuh E = 0. 199 V • jika digunakan KCl 3. 5 M maka E = 0. 205 V

Elektroda Indikator Elektroda yang potensialnya bergantung pada konsentrasi zat yang sedang diselidiki

Elektroda Kerja Logam n Elektroda Jenis Pertama Logam yang dicelupkan kedalam larutan ionnya Contoh: logam tembaga yang dicelupkan ke dalam larutan ion Cu 2+

Elektroda Jenis Pertama

Elektroda Jenis Kedua Elektroda logam yang dicelupkan ke dalam larutan yang dijenuhkan dengan garam sukar larut dari ion logam tersebut.

Elektroda Jenis Kedua

Example 4: Calculate the formation constant Kf for Ag(CN)2 - if the cell: SCE || Ag(CN)2 - (7. 50 x 10 -3 M, CN- (0. 0250 M)| Ag develops a potential of -0, 625 V

Elektroda Redoks Elektroda logam inert dicelupkan ke dalam larutan yang mengandung ion yang dapat mengalami reaksi reduksi/oksidasi di permukaan elektroda tersebut. Elektroda ini tidak terlibat dalam reaksi tersebut. Contoh: Fe 3+, Fe 2+ Pt

Elektroda Membran
![Selektifitas Membran AE dan IE adalah konsentrasi analit dan pengganggu yang memberikan nilai potensial Selektifitas Membran [A]E dan [I]E adalah konsentrasi analit dan pengganggu yang memberikan nilai potensial](https://slidetodoc.com/presentation_image_h/32efa54eafd0b6a56c9fd8a633301c7b/image-21.jpg)
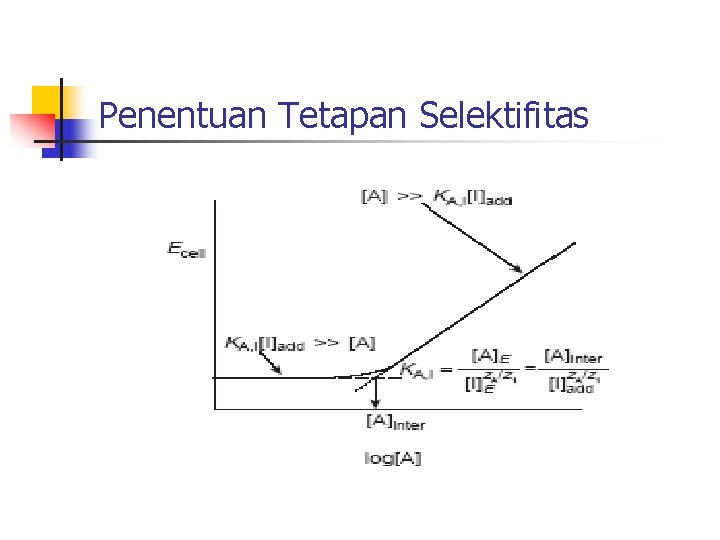
Selektifitas Membran [A]E dan [I]E adalah konsentrasi analit dan pengganggu yang memberikan nilai potensial sel yang sama

Penentuan Tetapan Selektifitas

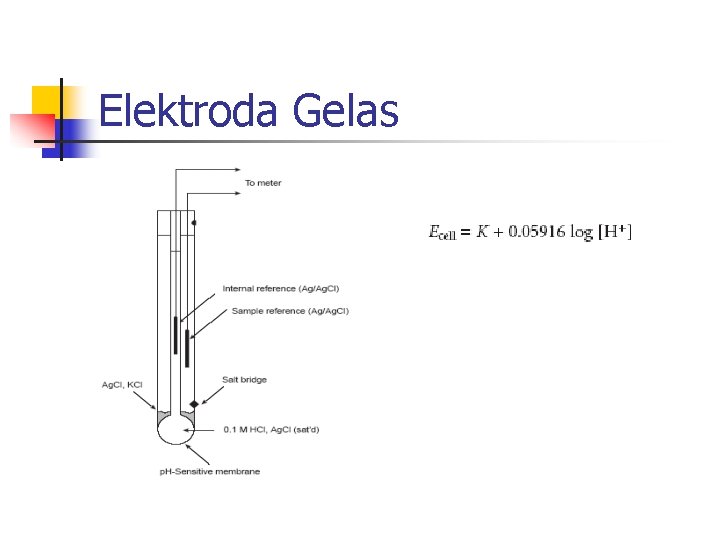
Elektroda Gelas

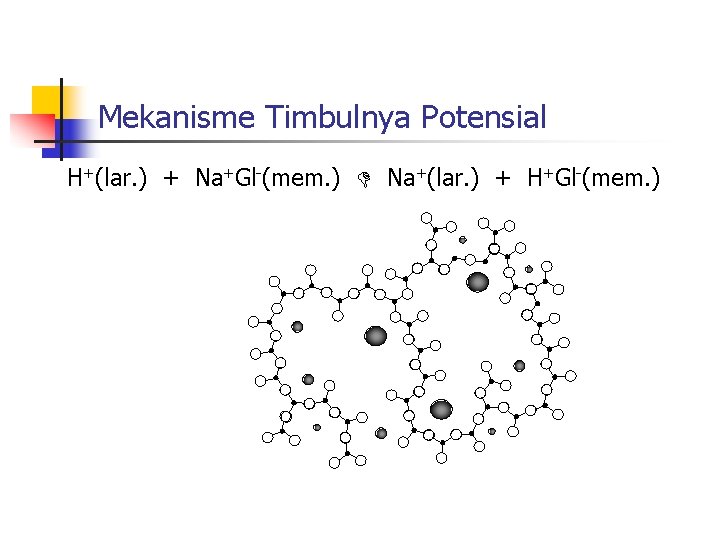
Mekanisme Timbulnya Potensial H+(lar. ) + Na+Gl-(mem. ) Na+(lar. ) + H+Gl-(mem. )

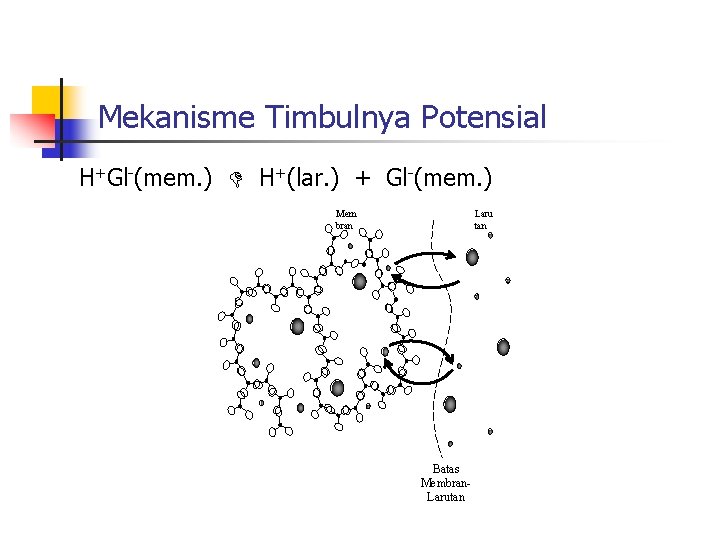
Mekanisme Timbulnya Potensial H+Gl-(mem. ) H+(lar. ) + Gl-(mem. ) Mem bran Laru tan Batas Membran. Larutan

ESI Kalsium

Aktivitas vs Konsentrasi Jika tetap

Ionic Strength Adjuster Kekuatan Ion ( ) Debeye-Huckel =diameter efektif ion

Analisis Kuantitatif n Method of external standards What is the concentration of Ca 2+ in the water sample if its cell potential is found to be -0. 084 V?

Quantitative Analysis n Method of Standard Additions Contoh: The concentration of Ca 2+ in a sample of sea water is determinedusing a Ca ion selective and a one point standard addition. A 10. 00 m. L sample is transferred to a 100 m. L volumetric flask and diluted to volume. A 50. 00 m. L aliquot of sample is placed in a beaker with the Ca ion-selective electrode and a reference electrode, and the potential is measured as -0. 05290 V. A 1. 00 m. L aliquot of a 5. 00 x 10 -2 M standard solution of Ca 2+ is added, and a potential of -0. 04417 V is measured. What is the concentration of Ca in the sample of sea water?

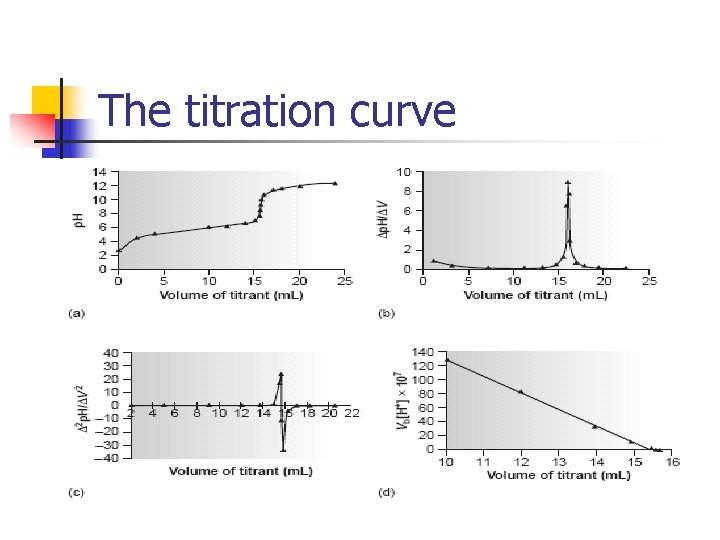
Titrasi Potensiometri n n n Elektroda kerja dan elektroda pembanding dicelupkan ke dalam larutan analit. Potensial sel diamati selama penambahan titran. Titik akhir ditentukan dari kurva titrasi

Titrasi Potensiometri

The titration curve
 Edi nasra
Edi nasra Plastida prokariotik dan eukariotik
Plastida prokariotik dan eukariotik Nasra tower
Nasra tower Vakuola berukuran besar
Vakuola berukuran besar Perbedaan sel tumbuhan dan sel hewan
Perbedaan sel tumbuhan dan sel hewan Macam-macam membran kehamilan
Macam-macam membran kehamilan Perbandingan antara sel haiwan dan sel tumbuhan
Perbandingan antara sel haiwan dan sel tumbuhan Transport antar membran
Transport antar membran Ecmap
Ecmap Qad edi
Qad edi Product activity 852
Product activity 852 Laurie burckhardt
Laurie burckhardt Scm edi
Scm edi Michaels stores edi
Michaels stores edi Identify language
Identify language Edi ii
Edi ii Edi b
Edi b Ierf usc
Ierf usc Edi onboarding process
Edi onboarding process Enel procurement
Enel procurement Edi basic concepts
Edi basic concepts What is edi in e commerce
What is edi in e commerce Stein mart edi
Stein mart edi Gxs vendor portal
Gxs vendor portal Fully managed edi
Fully managed edi Advantages of edi in e commerce
Advantages of edi in e commerce Edi sugiarto
Edi sugiarto Block essay
Block essay Edi in entrepreneurship
Edi in entrepreneurship Edi trends
Edi trends Wikipedia sidney crosby
Wikipedia sidney crosby Edi stands for
Edi stands for Acciones y
Acciones y Edi ax
Edi ax