Podstawy elektrochemii i korozji wykad dla III roku





- Slides: 15

Podstawy elektrochemii i korozji wykład dla III roku kierunków chemicznych Wykład II Dr Paweł Krzyczmonik Pracownia Elektrochemii i Korozji Uniwersytet Łódzki Luty 2017 1

Podstawy elektrochemii i korozji Podstawy procesów elektrodowych 1. Budowa podwójnej warstwy elektrochemicznej na granicy faz elektroda roztwór elektrolitu. 2. Procesy adsorpcji. Prąd faradajowski i pojemnościowy. 3. Równowagi w heterogenicznych układach elektrochemicznych. 4. Procesy elektrodowe samorzutne i wymuszone, rola potencjału elektrody. 5. Fenomenologiczna teoria szybkości procesów elektrodowych. 2

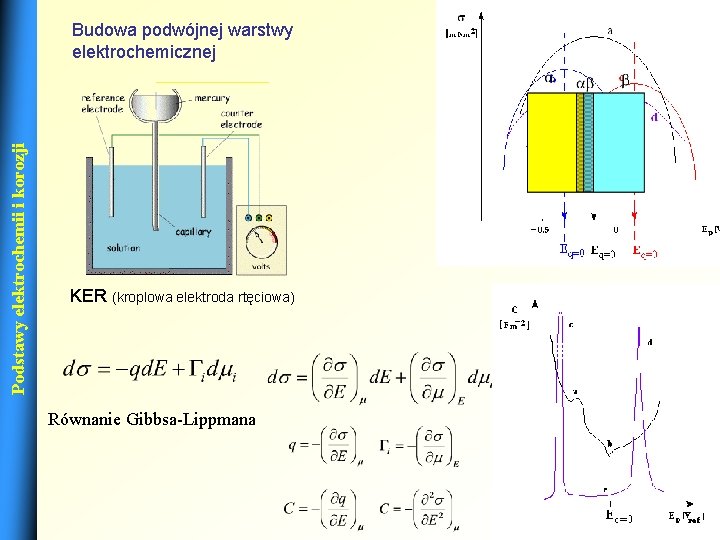
Podstawy elektrochemii i korozji Budowa podwójnej warstwy elektrochemicznej KER (kroplowa elektroda rtęciowa) Równanie Gibbsa-Lippmana 3

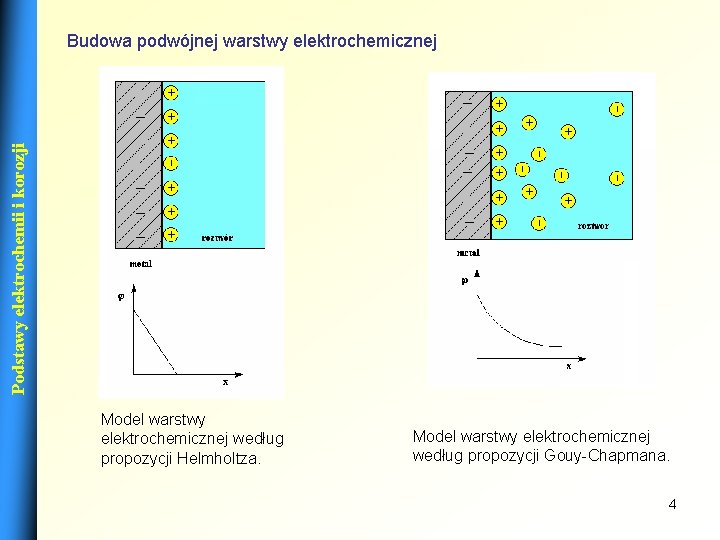
Podstawy elektrochemii i korozji Budowa podwójnej warstwy elektrochemicznej Model warstwy elektrochemicznej według propozycji Helmholtza. Model warstwy elektrochemicznej według propozycji Gouy-Chapmana. 4

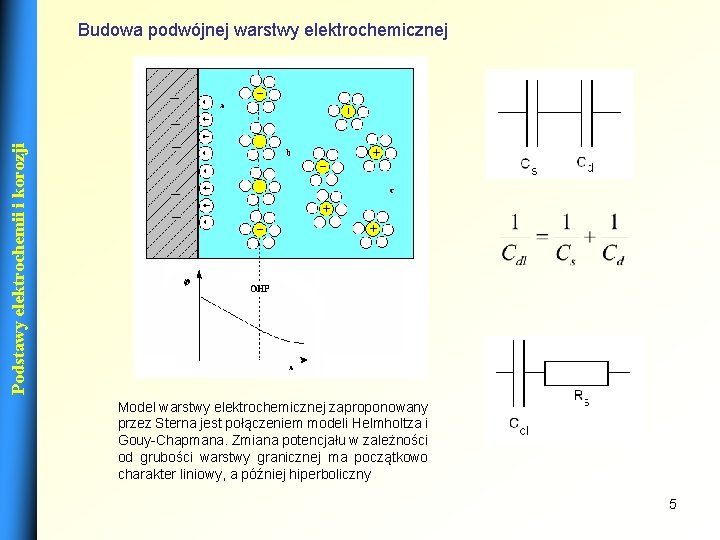
Podstawy elektrochemii i korozji Budowa podwójnej warstwy elektrochemicznej Model warstwy elektrochemicznej zaproponowany przez Sterna jest połączeniem modeli Helmholtza i Gouy-Chapmana. Zmiana potencjału w zależności od grubości warstwy granicznej ma początkowo charakter liniowy, a później hiperboliczny 5

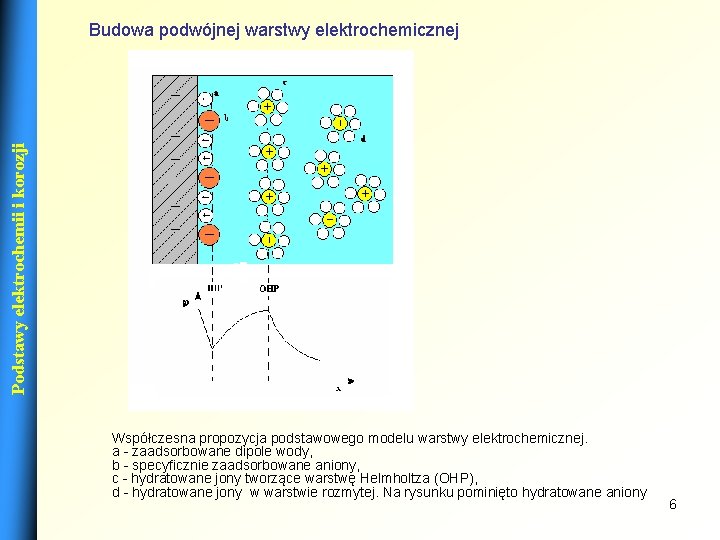
Podstawy elektrochemii i korozji Budowa podwójnej warstwy elektrochemicznej Współczesna propozycja podstawowego modelu warstwy elektrochemicznej. a - zaadsorbowane dipole wody, b - specyficznie zaadsorbowane aniony, c - hydratowane jony tworzące warstwę Helmholtza (OHP), d - hydratowane jony w warstwie rozmytej. Na rysunku pominięto hydratowane aniony 6

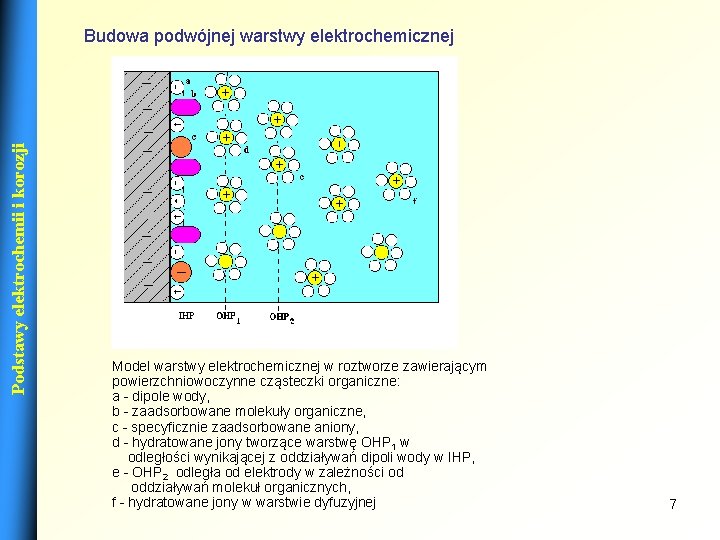
Podstawy elektrochemii i korozji Budowa podwójnej warstwy elektrochemicznej Model warstwy elektrochemicznej w roztworze zawierającym powierzchniowoczynne cząsteczki organiczne: a - dipole wody, b - zaadsorbowane molekuły organiczne, c - specyficznie zaadsorbowane aniony, d - hydratowane jony tworzące warstwę OHP 1 w odległości wynikającej z oddziaływań dipoli wody w IHP, e - OHP 2 odległa od elektrody w zależności od oddziaływań molekuł organicznych, f - hydratowane jony w warstwie dyfuzyjnej 7

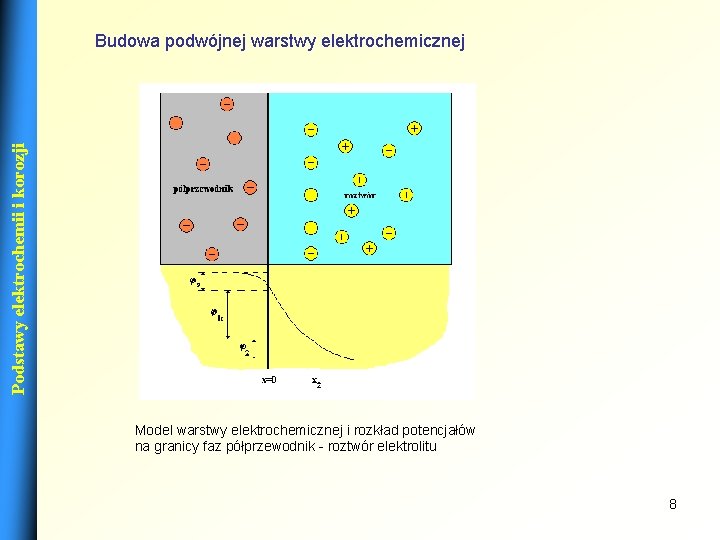
Podstawy elektrochemii i korozji Budowa podwójnej warstwy elektrochemicznej Model warstwy elektrochemicznej i rozkład potencjałów na granicy faz półprzewodnik - roztwór elektrolitu 8

Podstawy elektrochemii i korozji Procesy adsorpcji. Prąd faradajowski i pojemnościowy. Prąd faradajowski – związany z zachodzeniem procesów elektrodowych, utlenienia i redukcji i w związku z tym z przepływem ładunku przez granicę faz. Prąd pojemnościowy – związany z procesem ładowania warstwy podwójnej i procesami adsorbcji. Prąd związany z rozdzieleniem ładunku. Procesy adsorbcji Specyficzna adsorpcja anionów i kationów Specyficzna adsorpcja substancji organicznych nie ulegających procesom elektrodowym Specyficzna adsorpcja substancji organicznych ulegających procesom elektrodowym 9

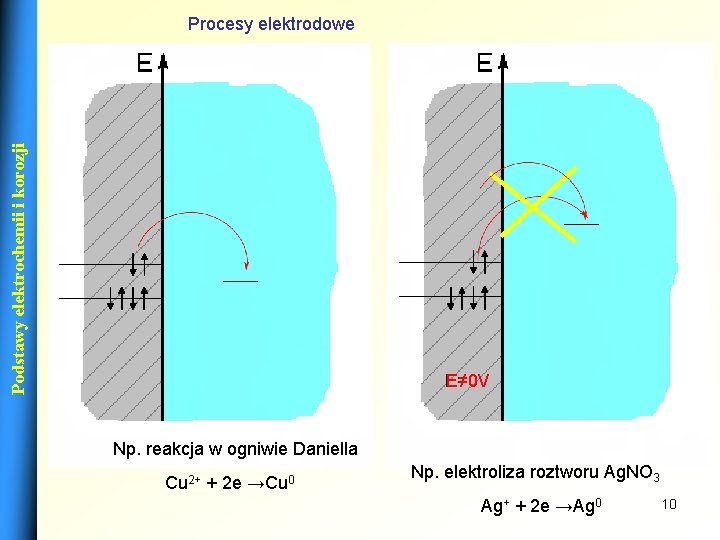
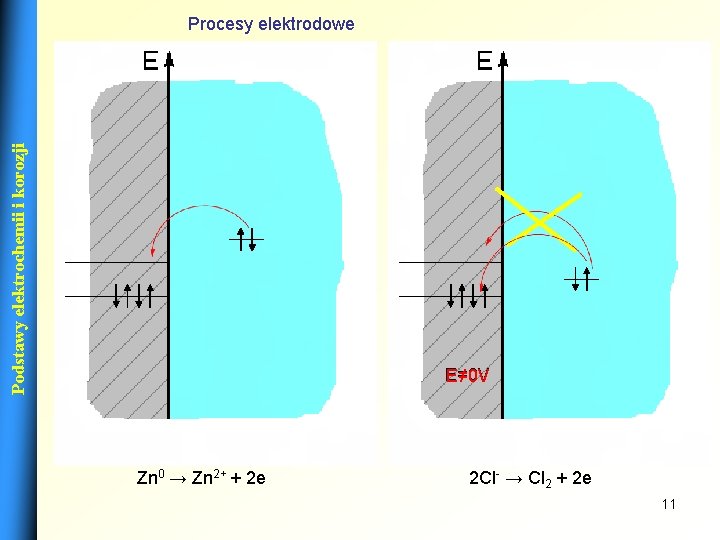
Podstawy elektrochemii i korozji Procesy elektrodowe E=0 V E≠ 0 V Np. reakcja w ogniwie Daniella Cu 2+ + 2 e →Cu 0 Np. elektroliza roztworu Ag. NO 3 Ag+ + 2 e →Ag 0 10

Podstawy elektrochemii i korozji Procesy elektrodowe E=0 V E≠ 0 V Zn 0 → Zn 2+ + 2 e 2 Cl- → Cl 2 + 2 e 11

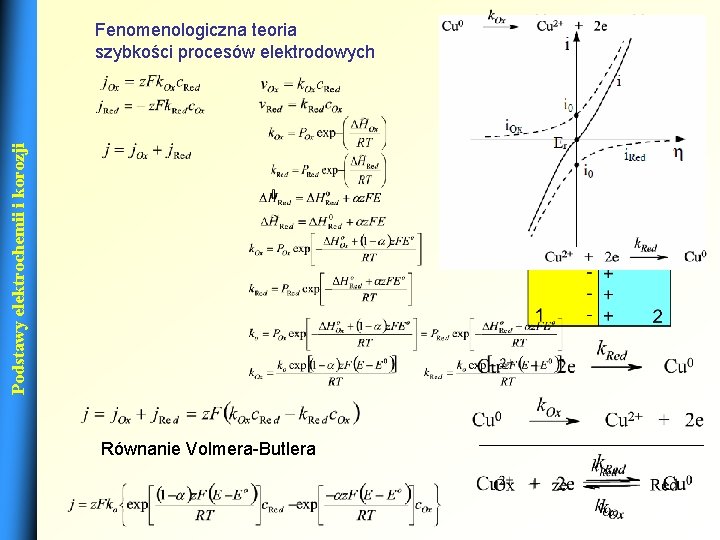
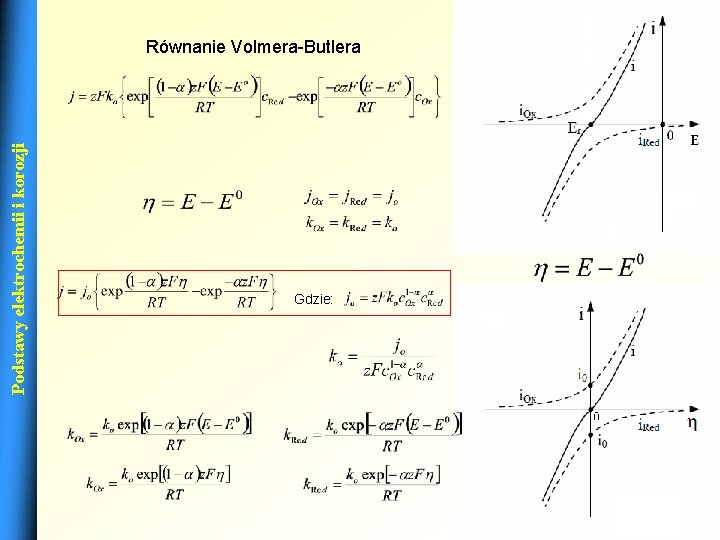
Podstawy elektrochemii i korozji Fenomenologiczna teoria szybkości procesów elektrodowych Równanie Volmera-Butlera 12

Podstawy elektrochemii i korozji Równanie Volmera-Butlera Gdzie: 13

Podstawy elektrochemii i korozji Literatura 1. J. O’M. Bockris, J. K. Reddy, Modern Electrochemistry, Plenum Rosetta, New York, 1973 2. H. Scholl, T. Błaszczyk , P. Krzyczmonik, " Elektrochemia - Zarys teorii i praktyki", Wyd. U Ł , 1998 3. I. Koryta, I. Dvorak, V. Bohackowa, "Elektrochemia", PWN , 1980. 4. G. Kortum, "Elektrochemia". 5. W. Libuś, Z. Libuś, "Elektrochemia", PWN , 1987. 6. A. J. Bard, G. Inzelt, F. Scholz, Electrochemical Dictionary Springer, 2008 7. A. Kisza, Elektrochemia I, Jonika, WNT Warszawa, 2000 8. A. Kisza, Elektrochemia II, Elektrodyka, WNT Warszawa, 2001 14

Podstawy elektrochemii i korozji Dziękuje za uwagę 15
 Běží to v potoku od roku do roku
Běží to v potoku od roku do roku Korozja metali
Korozja metali Jakie metale ulegają korozji
Jakie metale ulegają korozji Definicja korozji
Definicja korozji Hamlet act iii scene ii
Hamlet act iii scene ii Równanie schrodingera
Równanie schrodingera Teoretyczne podstawy informatyki
Teoretyczne podstawy informatyki Podstawy kryptografii
Podstawy kryptografii Monitorowanie realizacji podstawy programowej
Monitorowanie realizacji podstawy programowej Realizacja podstawy programowej w edukacji wczesnoszkolnej
Realizacja podstawy programowej w edukacji wczesnoszkolnej Oznaczenia na skalach mierników
Oznaczenia na skalach mierników Pole powierzchni graniastosłupa wzór
Pole powierzchni graniastosłupa wzór Język sql - podstawy zapytań
Język sql - podstawy zapytań Zasada prac przygotowanych belka
Zasada prac przygotowanych belka Mechanika kwantowa podstawy
Mechanika kwantowa podstawy Monitorowanie podstawy programowej wzór
Monitorowanie podstawy programowej wzór