Pavaloiu Mihai a8 a D Cuprins Notiuni introductive










- Slides: 11

Pavaloiu Mihai. a-8 -a D

Cuprins Notiuni introductive Raspandirea in natura Propietati fizice Propietati chimice Obtinerea hidrogenului Importanta utilizari Hidrogenul Atomi , Dozator,

Hidrogenul • Hidrogenul este elementul chimic în tabelulperiodic al elementeleor cu simbolul H şi numărul atomic 1. Este un gaz uşor inflamabil, incolor, insipid, inodor, iar în natură se întâlneşte mai ales sub formă de moleculă diatomică, H 2. Având masa atomică relativă egală cu 1, 00794, hidrogenul este cel mai uşor element chimic. Etimologic, cuvântul hidrogen este o combinaţie a două cuvinte greceşti, având semnificaţia de „a face apă”.

Raspandirea in natura • Hidrogenul este elementul cu mult cel mai raspandit din univers. In atmosfera stelelor calde si in spatiul interstelar, hidrogenul exista sub forma de atomi liberi. In interiorul stelelor foarte calde, hidrogenul este continut sub forma de protoni. Acestia apar si in razele cosmice, ca produsi secundari ai interactiunii razelor cosmice primare cu atomi mai grei. • In straturile exterioare solide si lichide ale globului pamantesc, accesibile cercetarii chimice, hidrogenul se gaseste (combinat cu alte elemente) in cantitate mica. Atmosfera Pamantului contine numai urme de hidrogen, in straturile superioare. Cea mai mare parte din hidrogenul de la suprafata Pamantului este combinat cu oxigenul , sub forma de apa. Printre celelalte combinatii importante ale hidrogenului, ce apar in natura sunt combinatiile organice din plante si animale.

Propietati fizice • Hidrogenul este un gaz fara culoare si fara miros. Dupa heliu, se lichefiaza cel mai greu dintre toate gazele. - Densitatea lui este mai mica decât a tuturor celorlalte gaze, având masa moleculara cca. 2, iar masa moleculara medie a gazelor din aer fiind 28, 9 , hidrogenul este de 14, 4 ori mai usor decât aerul. - Caldura specifica a hidrogenului este mai mare decât a celorlalte gaze - Viteza de difuziune a hidrogenului este mai mare decât a tuturor celorlalte gaze. Viteza de trecere a unui gaz printr-un orificiu îngust este invers proportionala cu radacina patrata a densitatii gazului. Cauza acestui fenomen este ca viteza medie, u , a moleculelor H 2. În miscarile lor termice, este la aceeasi temperatura mult mai mare decât a moleculelor celorlalte gaze.

Obtinerea hidrogenului • - In laborator, hidrogenul se prepara din zinc si acid clorhidric diluat, in aparatul Kipp sau in alte aparate similare sau prin electroliza unei solutii apoase de Na. OH. • - In industrie, se obtine hidrogen ca produs secundar, la fabricarea clorului si a hidroxidului de sodiu, prin procedee eletrolitice • - In cantitati mari, hidrogenul se obtine in industrie din asa-numitul “gaz de apa“, un amestec de H 2 + CO, ce ia nastere din carbune incandescent si apa : C + H 2 O. Oxidul de carbon din gazul de apa se « converteste » in hidrogen printr-o reactie catalitica (Fe) cu apa (CO + H 2 O CO 2 + H 2 ). Bioxidul de carbon format se indeparteaza prin dizolvare in apa rece, sub presiune.

Propietati chimice • Hidrogenul molecular este un gaz stabil termic pana la temperaturi ridicate • - Hidrogenul nu este deosebit de reactiv, energia de legatura a celor doi atomi in molecula H fiind mare. • - Combinarea hidrogenului cu nemetalele. Cu oxigenul si cu clorul , hidrogenul reactioneaza violent. Amestecuri stoechiometrice de hidrogen cu oxigen sau clor explodeaza cand vin in contact cu o flacara, o scanteie electrica sau, in cazul clorului, cand sunt expuse luminii. • 2 H 2+O 2 2 H 2 O • H 2 + Cl 2 2 HCl

Importatnta utilizari Hidrogenul molecular, serveste in cantitati foarte mari la fabricarea amoniacului. Serveste apoi in reactii de hidrogenare a legaturilor duble C=C din grasimi si din alti compusi organici, precum si pentru desulfurarea petrolurilor bogate in sulf. In ultimul timp, hidrogenul lichid este folosit drept combustibil pentru rachete.

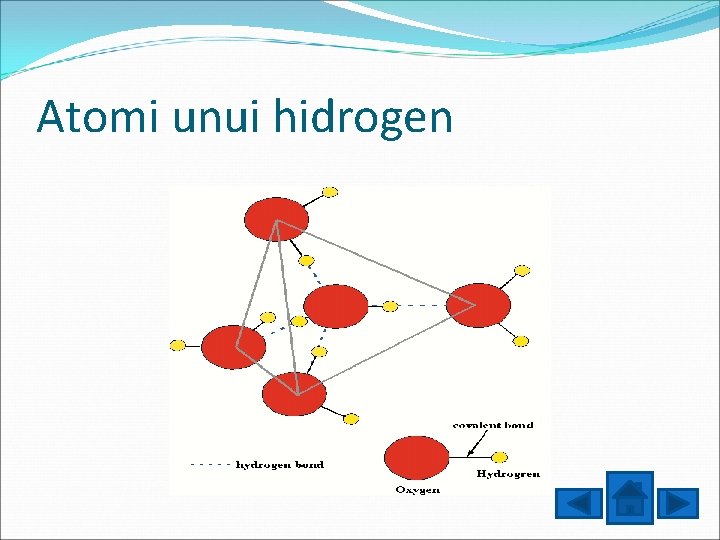
Atomi unui hidrogen

Dozator

Reactii





















