Nzev vzdlvacho materilu Rovnovhy slo vzdlvacho materilu ICT













- Slides: 15

Název vzdělávacího materiálu: Rovnováhy Číslo vzdělávacího materiálu: ICT 9/18 Šablona: III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Název sady vzdělávacích materiálů: Anorganická a obecná chemie Autor: Šárka Kirchnerová Datum vytvoření: 7. 6. 2014 Garant (kontrola): Jakub Siegl Ročník: Kvinta a 1. ročník gymnázia, Seminář z chemie Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Téma: Rovnováhy Metodika/anotace: Powerpointová prezentace slouží jako výukový materiál pro třídu kvinty a jako opakování k maturitě z chemie. Objasňuje základní pojmy z kapitoly Chemická rovnováha, vzorový příklad a inspiraci k dalšímu procvičování. Časový rozvrh: 45 min Gymnázium Františka Křižíka a základní škola, s. r. o.

CHEMICKÁ ROVNOVÁHA • stav, kdy je koncentrace reaktantů i produktů chemické reakce konstantní v čase (rychlost reakce přímé a zpětné je stejná) • chemická reakce neprobíhá tedy pouze zleva doprava, tak ji zapisuje chemická rovnice

CHEMICKÁ ROVNOVÁHA ODVOZENÍ Máme – li obecnou chemickou reakci a. A + b. B → c. C + d. D, neprobíhá tedy pouze reakce zleva doprava, ale také reakce c. C + d. D → a. A + b. B

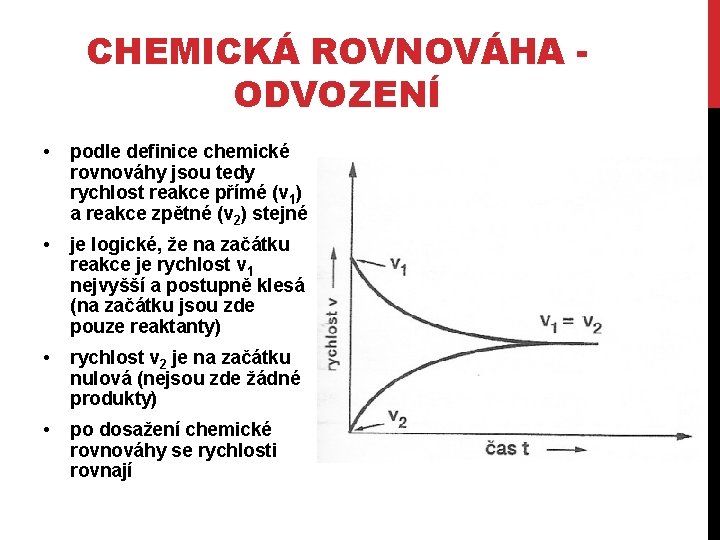
CHEMICKÁ ROVNOVÁHA ODVOZENÍ • podle definice chemické rovnováhy jsou tedy rychlost reakce přímé (v 1) a reakce zpětné (v 2) stejné • je logické, že na začátku reakce je rychlost v 1 nejvyšší a postupně klesá (na začátku jsou zde pouze reaktanty) • rychlost v 2 je na začátku nulová (nejsou zde žádné produkty) • po dosažení chemické rovnováhy se rychlosti rovnají

CHEMICKÁ ROVNOVÁHA ODVOZENÍ • rychlost chemické reakce je přímo úměrná součinu okamžitých koncentrací výchozích látek v 1=k 1. [A]a. [B]b v 1……………. . rychlost přímé reakce k 1……………. . rychlostní konstanta pro danou teplotu a tlak, zahrnuje teplotu a aktivační energii A ……………. . látka A a ……………. . řád reakce (v jednoduchých rovnicích stechiometrický koeficient) B ……………. . látka B b ……………. . řád reakce (v jednoduchých rovnicích stechiometrický koeficient) [ ]……………. . okamžitá koncentrace mol/dm 3

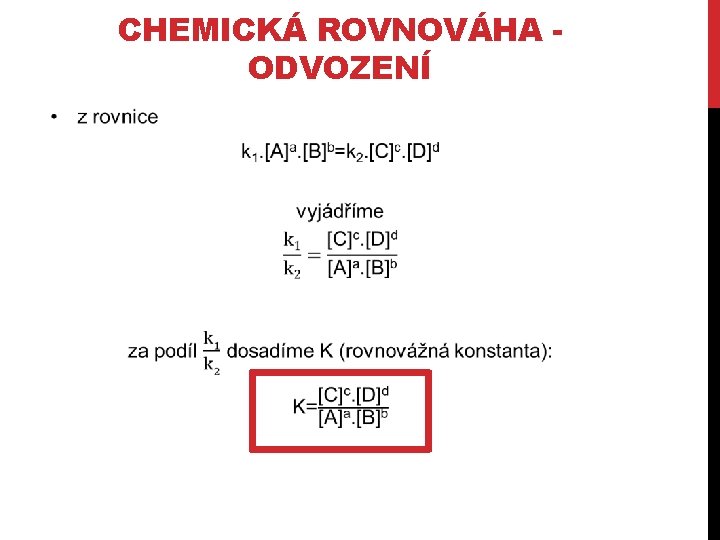
CHEMICKÁ ROVNOVÁHA ODVOZENÍ • pro obecnou rovnici a. A + b. B → c. C + d. D platí v 1=k 1. [A]a. [B]b v 2=k 2. [C]c. [D]d • po dosažení chemické rovnováhy se rychlosti v 1 a v 2 vyrovnají: k 1. [A]a. [B]b=k 2. [C]c. [D]d

CHEMICKÁ ROVNOVÁHA ODVOZENÍ


Další příklady k procvičení: Vyjádřete rovnovážnou konstantu reakcí: CH 3 COOH + CH 3 OH CH 3 COOCH 3 + H 2 O CO 2 + C 2 CO H 2 + Cl 2 2 HCl

PRINCIP POHYBLIVÉ ROVNOVÁHY • představuje aplikaci principu akce a reakce na chemické rovnováhy • známější je pod názvem LE CHATELIERŮV PRINCIP: • říká, že jakékoli vnější působení na chemickou soustavu v rovnováze vyvolává děje, kterými se soustava snaží vnější působení eliminovat. • Vnějším působením přitom může být: • • • změna koncentrace jedné ze složek zúčastněných v chemické reakci změna teploty změna tlaku

VLIV KONCENTRACE • Pokud změníme koncentraci kterékoli látky, která se zúčastňuje reakce, posuneme tím rovnováhu celé soustavy. • Přidáním jednoho z produktů zvýšíme jeho koncentraci. Hodnota K se zvýší. • Protože hodnota K ale musí zůstat stejná, vyvolá tato akce reakci: část přidaného množství se přemění zpět na reaktanty. • Tím dojde ke zvýšení koncentrace produktů a hodnota K zůstane zachována.

VLIV TEPLOTY • Pokud je reakce přímá exotermní, teplo se při ní uvolňuje. • Zahřívání (akce) vyvolá reakci, která povede k eliminaci vlivu tepla. • Toho soustava dosáhne tím, že bude ve zvýšené míře probíhat reakce, která je endotermní (v našem případě ve směru reaktantů).

VLIV TLAKU • Vliv tlaku se projevuje pouze u reakcí, u kterých dochází při reakci ke změně objemu. • Příkladem je reakce 2 CO + O 2 2 CO 2, kde jsou reaktanty i produkty v plynné fázi. • Při reakci zleva doprava dochází ke zmenšení objemu. • Pokud bude soustava v rovnováze a budeme na ni působit zvýšením tlaku, bude soustava na zvýšení tlaku reagovat posunem rovnováhy zleva doprava. • Posun rovnováhy zleva doprava vede v případě této reakce ke snížení objemu, což je eliminování zvýšení tlaku. • V případě reakce, kdy se objem reakční soustavy nemění, nemá tlak vliv na rovnováhu chemické reakce.

SHRNUTÍ

ZDROJE OBRÁZKŮ (K 7. 6. 2014) Rychlost chemické reakce: http: //absolventi. gymcheb. cz/2008/ivblech/chemicka%20 kinetika% 202. html Princip akce a reakce: physics. mff. cuni. cz/kchfo/burda/OCh/Part 07





























