NHM V HP CHT CA NHM NHM I

























- Slides: 30

NHÔM VÀ HỢP CHẤT CỦA NHÔM

NHÔM

I. VỊ TRÍ TRONG BTH, CẤU HÌNH ELECTRON NGUYÊN TỬ. 13 Al: 1 s 22 p 63 s 23 p 1 hay [Ne] 3 s 23 p 1 v Đặc điểm của nguyên tố Al: Có 3 e lớp ngoài cùng (3 s 23 p 1) Trong h/chất có số oh là +3 v Vị trí của Al trong BTH: • Ô: 13 • Chu kỳ: 3 • Nhóm: IIIA 3

II. TÍNH CHẤT VẬT LÝ: • Nhôm là kloại màu trắng bạc, • mềm dễ kéo sợi và dát mỏng, • dẫn điện và dẫn nhiệt tốt. • Nhôm là kloại nhẹ (D=2, 7 g/cm 3 ), • nóng chảy 660 o. C. 4

III. TÍNH CHẤT HÓA HỌC: Nhôm là kl có tính khử mạnh, chỉ sau kl kiềm và kiềm thổ, nên dễ bị oxi hóa ion dương Al → Al 3+ + 3 e 5

1/ Tác dụng với phi kim : 4 Al + 3 O 2(to) → 2 Al 2 O 3 2 Al + 3 Cl 2 (to) → 2 Al. Cl 3 2 Al + 3 S (to) → Al 2 S 3 Chú ý : Al 2 S 3 chỉ bền khi ở trạng thái rắn. Trong dd bị thủy phân hoàn toàn : Al 2 S 3 + 6 H 2 O → 2 Al(OH)3 ↓ + 3 H 2 S ↑

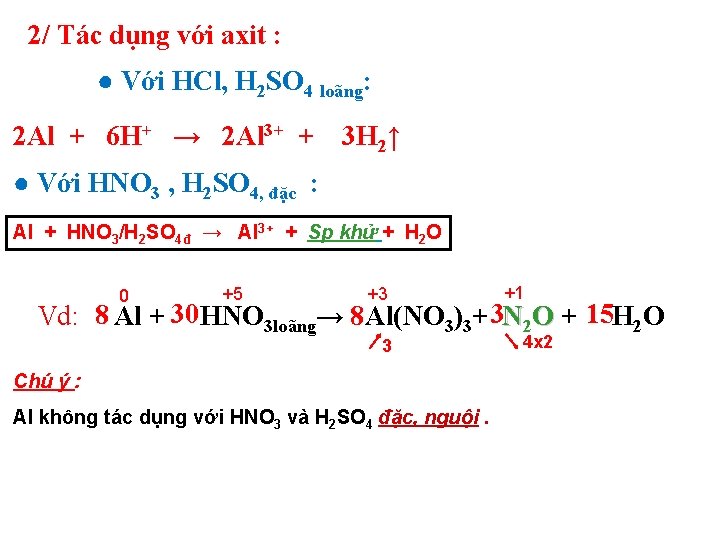
2/ Tác dụng với axit : ● Với HCl, H 2 SO 4 loãng: 2 Al + 6 H+ → 2 Al 3+ + 3 H 2↑ ● Với HNO 3 , H 2 SO 4, đặc : Al + HNO 3/H 2 SO 4đ → Al 3+ + Sp khử + H 2 O 0 +5 +3 +1 Vd: 8 Al + 30 HNO 3 loãng→ 8 Al(NO 3)3+ 3 N 2 O + 15 H 2 O 3 Chú ý : Al không tác dụng với HNO 3 và H 2 SO 4 đặc, nguội. 4 x 2

3/ Tác dụng với oxit kim loại : 2 Al + Fe 2 O 3 2 Al + 3 Cu. O 2 y. Al + t 0 C 3 Fex. Oy (to) → Al 2 O 3 + 2 Fe Al 2 O 3 + 3 Cu y. Al 2 O 3 + 3 x. Fe Phản ứng trên được gọi là phản ứng nhiệt nhôm. (toả nhiều nhiệt, làm sắt nóng chảy, dùng hàn đường ray) 8

4/ Tác dụng với nước : Vật bằng nhôm không tác dụng với nước ở bất kỳ nhiệt độ nào vì trên bề mặt nhôm được phủ bởi một lớp Al 2 O 3 rất bền. Nếu phá bỏ lớp bảo vệ này, thì nhôm tác dụng được với nước. 2 Al + 6 H 2 O → 2 Al(OH)3 + 3 H 2 ↑ Al(OH)3 là chất rắn, không tan trong nước, ngăn cách Al tiếp xúc với H 2 O nên pư bị dừng lại. */ Giải thích tại sao Al là kim loại hoạt động mạnh , nhưng ta có thể dùng các đồ dùng bằng nhôm để nấu nước? Vật dụng bằng Al bị oxi hóa tạo nên 1 lớp Al 2 O 3 rất bền ở bên ngoài và lớp oxit này không có phản ứng với nước. 9

Tóm lại, - Al không tác dụng H 2 O trong các bài tập (Al + H 2 O không xảy ra)

5/ Tác dụng với dung dịch kiềm ( Na. OH, KOH, Ca(OH)2…) Vd: Cho Al vào dung dịch Na. OH thì: Al 2 O 3 + 2 Na. OH 2 Na. Al. O 2 + H 2 O 2 Al + 6 H 2 O 2 Al(OH)3 + 3 H 2 ↑ Al(OH)3 + Na. OH Na. Al. O 2+ 2 H 2 O Al + Na. OH + H 2 O → Na. Al. O 2 + 3/2 H 2 ↑ 11

IV. ĐIỀU CHẾ 1. Nguyên liệu: Quặng Boxit ( Al 2 O 3. 2 H 2 O ) 2. Phương pháp điều chế: Điện phân nóng chảy Al 2 O 3 có mặt criolit Na 3 Al. F 6 2 Al 2 O 3 đpnc 4 Al + 3 O 2 Vai trò của criolit Na 3 Al. F 6 - Hạ nhiệt độ nóng chảy của Al 2 O 3 từ 20500 C xuống 9000 C. - Tăng độ dẫn điện do tạo thành nhiều ion hơn. Nhôm sinh ra tinh khiết hơn. - Tạo lớp bảo vệ không cho O 2 phản ứng với Al nóng chảy. 12

HỢP CHẤT CỦA NHÔM 13

Al 2 O 3 - Nhôm oxit I. Lý tính : - Al 2 O 3 chất rắn, màu trắng, không tan trong nước, nóng chảy ở 20500 C - Trong tự nhiên có hai dạng nhôm oxit : Dạng ngậm nước Al 2 O 3. 2 H 2 O có trong quặng boxit Dạng khan như emeri, corindon (ngọc thạch) , . . . II. Hóa tính : là oxit lưỡng tính. ● Tính bazơ: Al 2 O 3 + 6 HCl → 2 Al. Cl 3 + 3 H 2 O ● Tính axit: Al 2 O 3 + 2 Na. OH → 2 Na. Al. O 2 + H 2 O III. Điều chế : t 0 C 2 Al(OH)3 → Al 2 O 3 + 3 H 2 O t 0 C 4 Al(NO 3)3 → 2 Al 2 O 3 +12 NO 2 + 3 O 2

Al(OH)3 – NHÔM HIDRÔXIT I. Lý tính : Chất rắn màu trắng, không tan trong nước. II. Hóa tính : Là hidroxit lưỡng tính. ● Tính bazơ: Al(OH)3 + 3 HCl → Al. Cl 3 + 3 H 2 O ● Tính axit: Al(OH)3 + Na. OH → Na. Al. O 2 + 2 H 2 O Chú ý : Natri aluminat Hợp chất lưỡng tính chỉ tác dụng với axit mạnh và bazơ mạnh. ● Phản ứng nhiệt phân : t 0 C 2 Al(OH)3 → Al 2 O 3 + 3 H 2 O

III. Điều chế Al(OH)3 : Cách 1: Al 3+ + 3 OH- (vừa đủ) → Al(OH)3 Al 3+ + 3 NH 3 + 3 H 2 O → Al(OH)3 + 3 NH 4+ Cách 2: Al. O 2 - + CO 2 + 2 H 2 O → Al(OH)3 + HCO 3 Al. O 2 - + H+ (vừa đủ) + H 2 O → Al(OH)3 16

Phèn chua K 2 SO 4. Al 2(SO 4)3. 24 H 2 O hay KAl(SO 4)2. 12 H 2 O 17

Ứng dụng của phèn chua: Ø Phèn chua làm trong nước. Ø Phèn chua dùng trong y học. Ø Dùng trong công nghiệp giấy, chất cầm màu, dùng trong ngành công nghiệp thuộc da. Chú ý: Khi thay thế K+ bằng Li+, Na+, NH 4+ thì ta được phèn nhôm 18

Cách nhận biết ion Al 3+ Thuốc thử: dung dịch kiềm. Hiện tượng: lúc đầu có kết tủa keo trắng xuất hiện, sau đó tan dần trong kiềm dư. Al 3+ + 3 OH- Al(OH)3 + OH- Al. O 2 - + 2 H 2 O 19

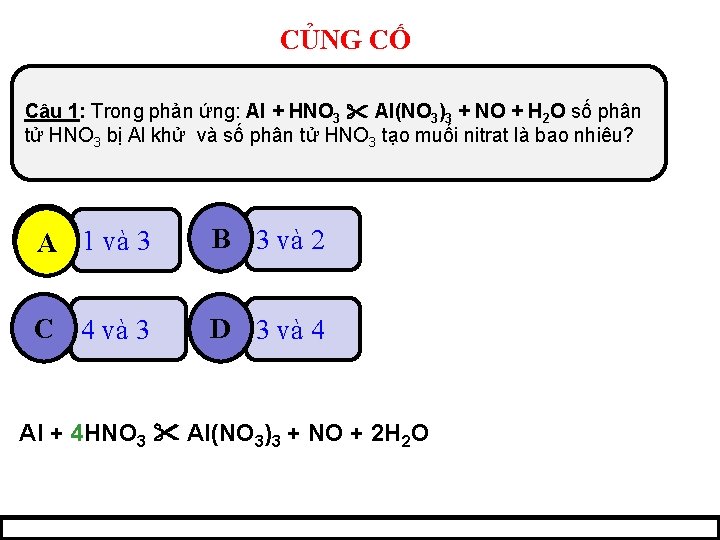
CỦNG CỐ Câu 1: Trong phản ứng: Al + HNO 3 Al(NO 3)3 + NO + H 2 O số phân tử HNO 3 bị Al khử và số phân tử HNO 3 tạo muối nitrat là bao nhiêu? A 1 và 3 B 3 và 2 C 4 và 3 D 3 và 4 Al + 4 HNO 3 Al(NO 3)3 + NO + 2 H 2 O

Câu 2: Nhôm bền trong không khí và nước là do: A Nhôm là kloại kém hoạt động. B Có màng Al 2 O 3 bền vững bảo vệ. C Có màng Al(OH)3 bền vững bảo vệ. D Nhôm thụ động với không khí và nước.

Câu 3: Phát biểu nào dưới đây là đúng ? A Nhôm là kim loại lưỡng tính B Al(OH)3 là bazơ lưỡng tính C Al 2 O 3 là oxit trung tính D Al(OH)3 là hidroxit lưỡng tính

Câu 4: Nhôm hidroxit thu được từ cách làm nào sau đây? A Cho dư dd HCl vào dd natri aluminat B Thổi dư khí CO 2 vào dd natri aluminat C Cho dư dd Na. OH vào dd Al. Cl 3 D Cho Al 2 O 3 tác dụng với nước Na. Al. O 2 + CO 2 + 2 H 2 O Al(OH)3 + Na. HCO 3

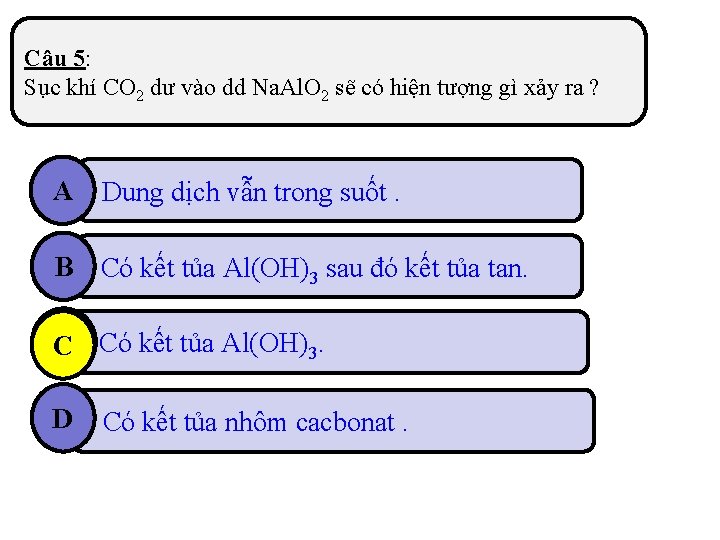
Câu 5: Sục khí CO 2 dư vào dd Na. Al. O 2 sẽ có hiện tượng gì xảy ra ? A Dung dịch vẫn trong suốt. B Có kết tủa Al(OH)3 sau đó kết tủa tan. C Có kết tủa Al(OH)3. D Có kết tủa nhôm cacbonat.

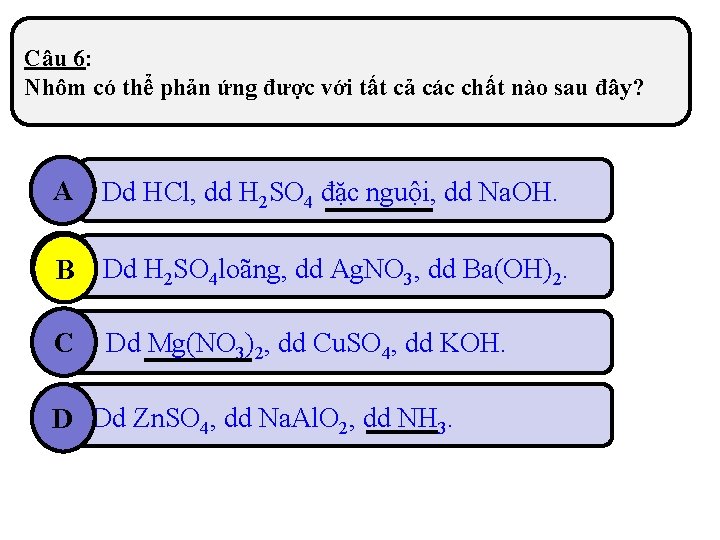
Câu 6: Nhôm có thể phản ứng được với tất cả các chất nào sau đây? A Dd HCl, dd H 2 SO 4 đặc nguội, dd Na. OH. B Dd H 2 SO 4 loãng, dd Ag. NO 3, dd Ba(OH)2. C Dd Mg(NO 3)2, dd Cu. SO 4, dd KOH. D Dd Zn. SO 4, dd Na. Al. O 2, dd NH 3.

Câu 7: Các chất nào sau đây vừa tác dụng với dung dịch axit mạnh vừa tác dụng với dung dịch bazơ mạnh? A B Al(OH)3, Al 2 O 3, Na. HCO 3. Al 2 O 3, Al, Mg. C Al(OH)3, Fe(OH)3, Cu. O. D Al, Zn. O, Fe. O.

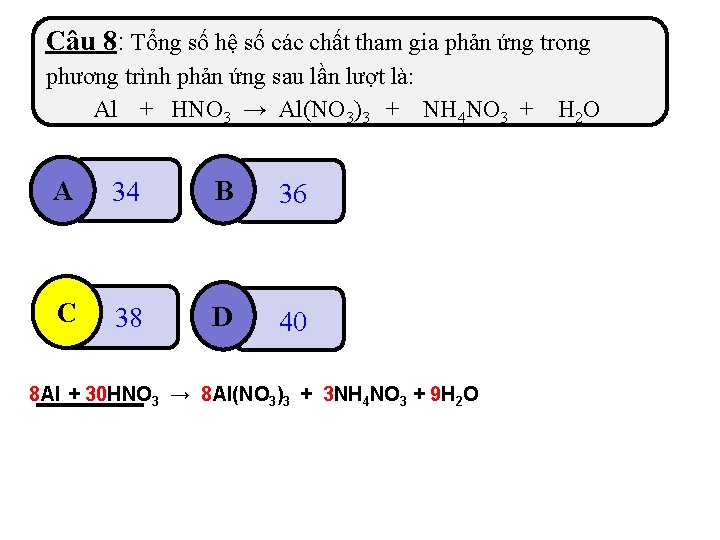
Câu 8: Tổng số hệ số các chất tham gia phản ứng trong phương trình phản ứng sau lần lượt là: Al + HNO 3 → Al(NO 3)3 + NH 4 NO 3 + A 34 B 36 C 38 D 40 8 Al + 30 HNO 3 → 8 Al(NO 3)3 + 3 NH 4 NO 3 + 9 H 2 O

Câu 9. Nung h/hợp X gồm bột Al và Fe 2 O 3 trong ĐK không có KK đến pư hoàn toàn, thu được h/hợp Y. Hòa tan Y trong Na. OH dư thu được H 2. Trong Y gồm: A. Al 2 O 3, Fe B. Al 2 O 3, Fe, Al C. Al 2 O 3, Fe 2 O 3 D. Cả 3 đều đúng • 2 Al + Fe 2 O 3 2 Fe + Al 2 O 3 Hỗn hợp Y phải có Al dư (Vì t/d Na. OH khí H 2) Vậy chọn B

Câu 10. Trong 1 lít dung dịch Al 2(SO 4)3 0, 15 M có tổng số mol các ion do muối phân li ra (bỏ qua sự thuỷ phân của muối) là A. 0, 15 mol B. 0, 3 mol C. 0, 45 mol D. 0, 75 mol Al 2(SO 4)3 2 Al 3+ + 3 SO 420, 15 mol 0, 3 0, 45 Tổng mol các ion = 0, 75 Chọn D

CÁC EM NHỚ HỌC BÀI VÀ LÀM BÀI TẬP TRONG ĐỀ CƯƠNG TRANG 68, 69, 70. 30