MADDENN ZELLKLERve TERMODNAMK SAF MADDE Her noktasnda ayn













- Slides: 30

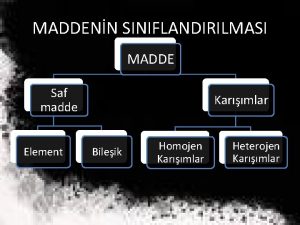
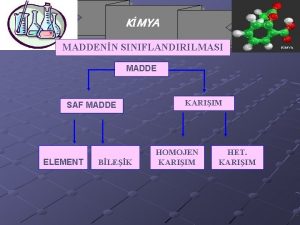
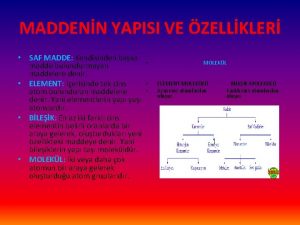
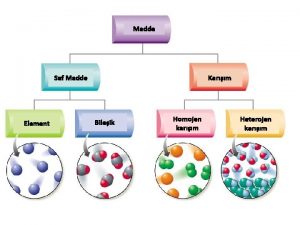
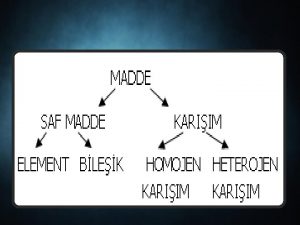
MADDENİN ÖZELLİKLERİve. TERMODİNAMİK SAF MADDE Her noktasında aynı ve değişmeyen bir kimyasal bileşme sahip olan maddeye saf madde adı verilir. Su, azot, helyum, hidrojen, karbondioksit, saf maddedir Saf maddenin sadece bir tek kimyasal element veya bileşiminden oluşması gerekmez. Değişik kimyasal elementlerden veya bileşimlerden oluşan bir karışımda, homojen olduğu sürece saf madde kabul edilir. Hava değişik gazlardan oluşan bir karışımdır, kimyasal bileşimi her noktada aynı ve değişmez olduğu için saf maddedir.

Azot ve gaz hava birer saf maddedir Su ve yağ karışımı saf bir madde sayılamaz, çünkü böyle bir karışımda yağ, suda çözülmeyip üstte toplandığından homojen bir kimyasal karışım oluşturmazlar. Saf bir maddenin iki veya daha çok fazının bir arada bulunduğu bir karışımda, fazların kimyasal bileşiminde bir farklılık olmadığı sürece saf madde kapsamına girer. Sıvı buhar karışımı saf bir maddedir, çünkü her iki fazında kimyasal bileşimi aynıdır.

Sıvı buhar karışımı su saf bir maddedir, fakat sıvı ve gaz havanın karışımı saf bir madde değildir. SAF MADDENİN FAZLARI Maddeler değişik şartlarda farklı fazlarda bulunabilir. Oda sıcaklığında ve basıncında bakır katıdır, civa sıvıdır, azot ise gazdır. Temelde katı, sıvı ve gaz olmak üzere üç grup faz vardır. Fakat her temel faz içinde farklı molekül düzenine sahip başka fazlarda olabilir. Örnek olarak karbon, katı fazı içinde grafit veya elmas fazlarında bulunabilir.

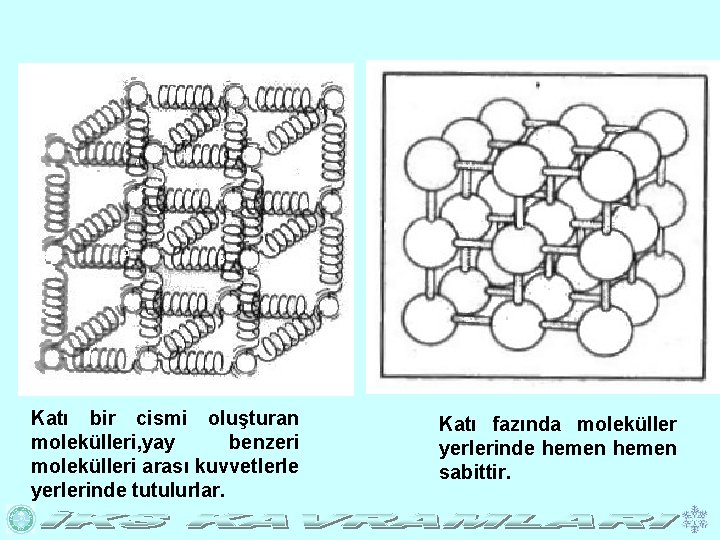
Katı bir cismi oluşturan molekülleri, yay benzeri molekülleri arası kuvvetlerle yerlerinde tutulurlar. Katı fazında moleküller yerlerinde hemen sabittir.

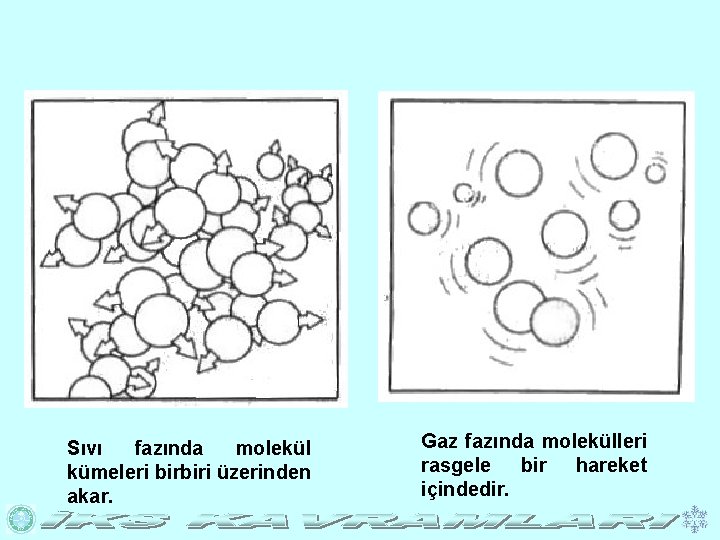
Sıvı fazında molekül kümeleri birbiri üzerinden akar. Gaz fazında molekülleri rasgele bir hareket içindedir.

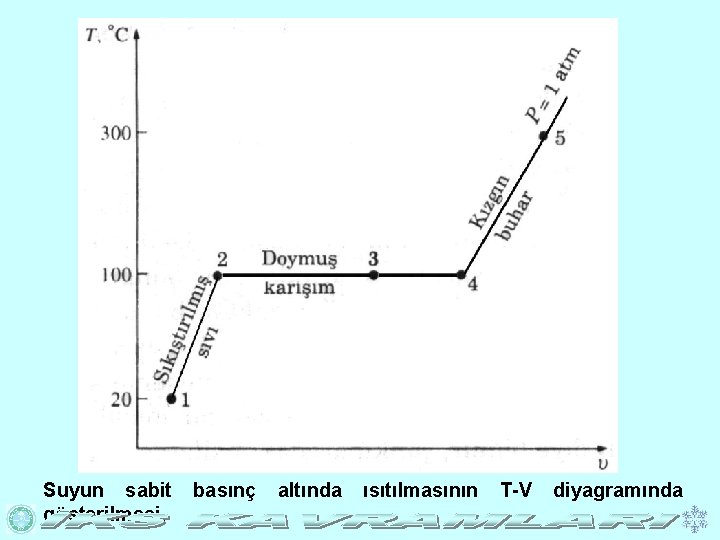
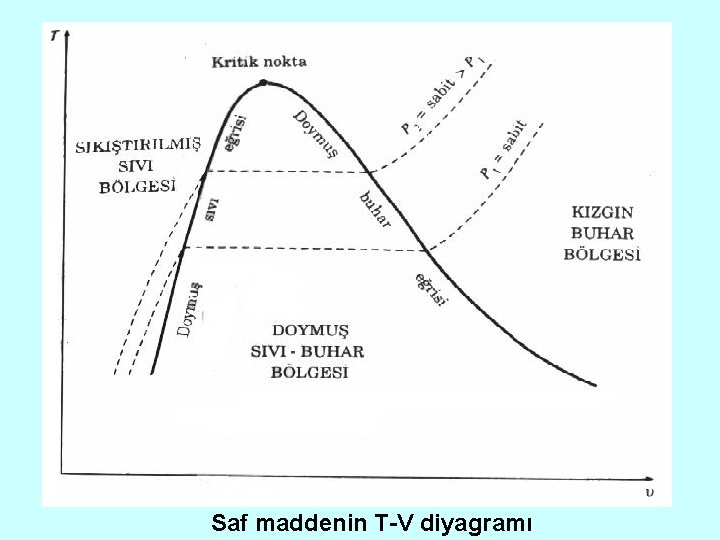
SAF MADDELERİN FAZ DEĞİŞTİRDİKLERİ HAL DEĞİŞİMLERİ Saf madenin iki fazının bir arada bulunduğu durumlarla sık karşılaşırlır. Su bir kazanda veya buharlı güç santralinin yoğuşturucusunda sıvı buhar karışımı olarak bulunur. Buzdolabının soğutucusunda soğutucu akışkan, sıvıdan buhara dönüşür. Sıkıştırılmış Sıvı 1 atm basınç ve 20 C sıcaklıkta su sıvı fazındadır. (Sıkıştırılmış sıvı)

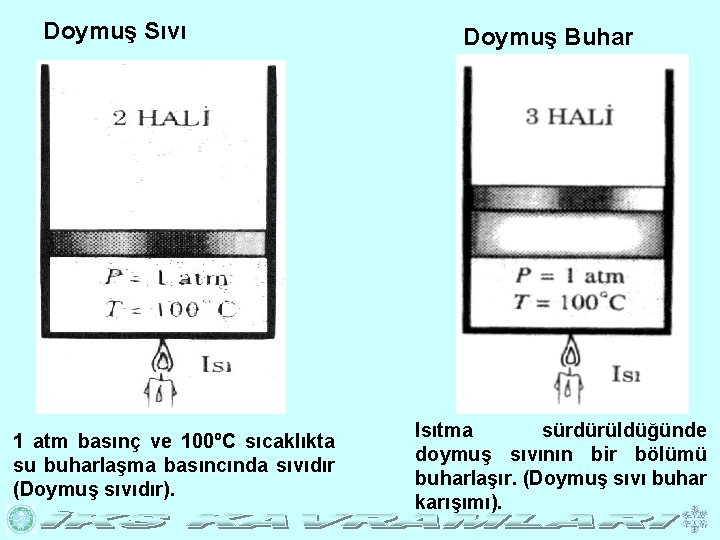
Doymuş Sıvı 1 atm basınç ve 100ºC sıcaklıkta su buharlaşma basıncında sıvıdır (Doymuş sıvıdır). Doymuş Buhar Isıtma sürdürüldüğünde doymuş sıvının bir bölümü buharlaşır. (Doymuş sıvı buhar karışımı).

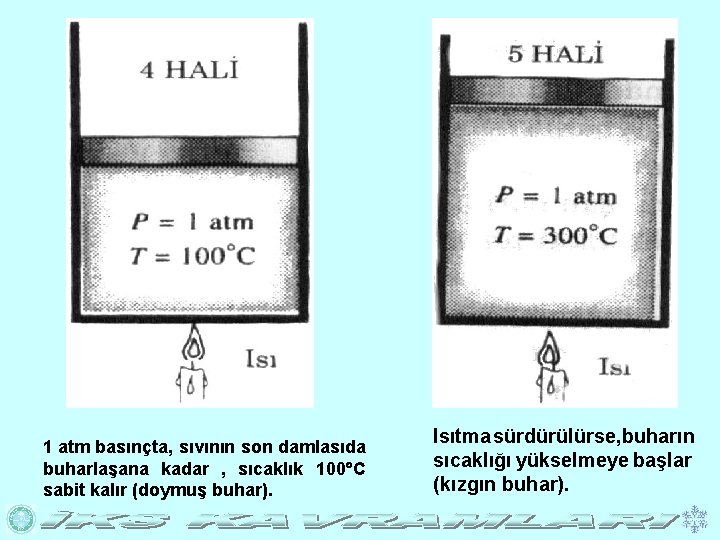
1 atm basınçta, sıvının son damlasıda buharlaşana kadar , sıcaklık 100 C sabit kalır (doymuş buhar). Isıtma sürdürülürse, buharın sıcaklığı yükselmeye başlar (kızgın buhar).

Suyun sabit gösterilmesi. basınç altında ısıtılmasının T-V diyagramında

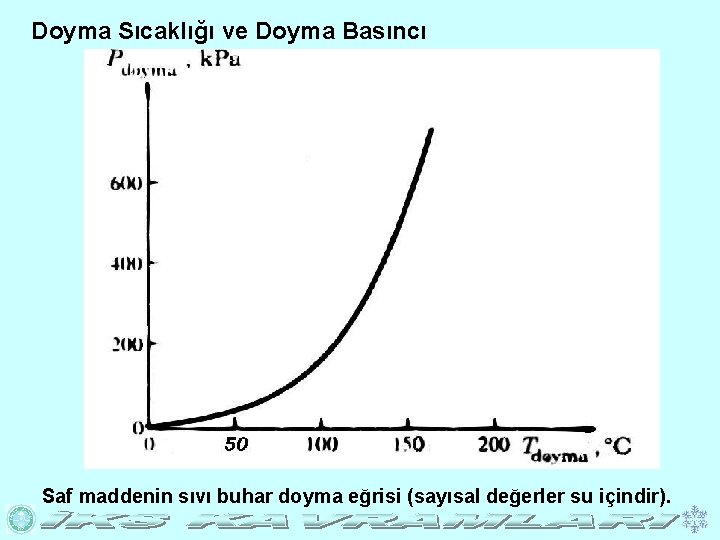
Doyma Sıcaklığı ve Doyma Basıncı Saf maddenin sıvı buhar doyma eğrisi (sayısal değerler su içindir).

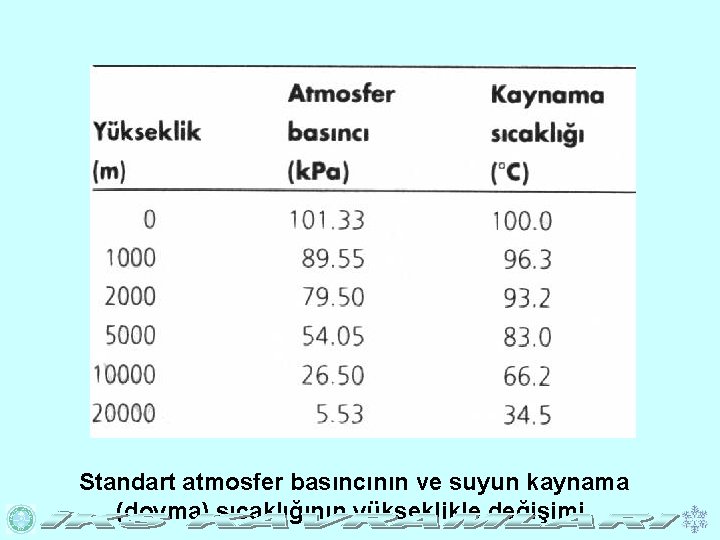
Standart atmosfer basıncının ve suyun kaynama (doyma) sıcaklığının yükseklikle değişimi.

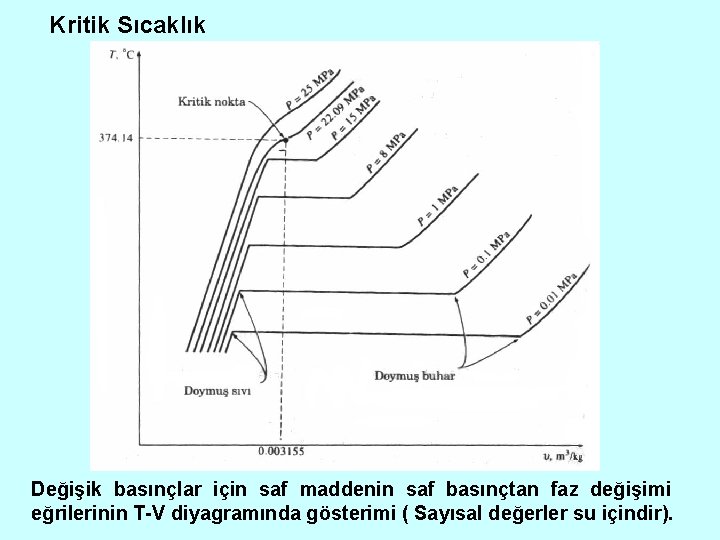
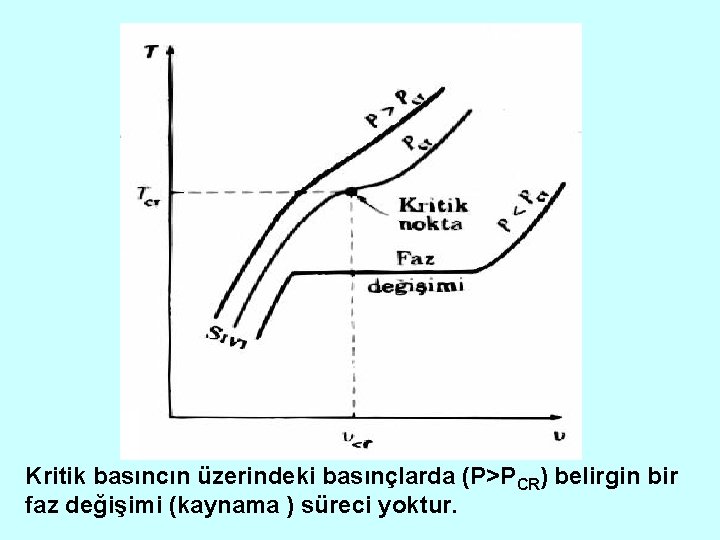
Kritik Sıcaklık Değişik basınçlar için saf maddenin saf basınçtan faz değişimi eğrilerinin T-V diyagramında gösterimi ( Sayısal değerler su içindir).

Kritik basıncın üzerindeki basınçlarda (P>PCR) belirgin bir faz değişimi (kaynama ) süreci yoktur.

Saf maddenin T-V diyagramı

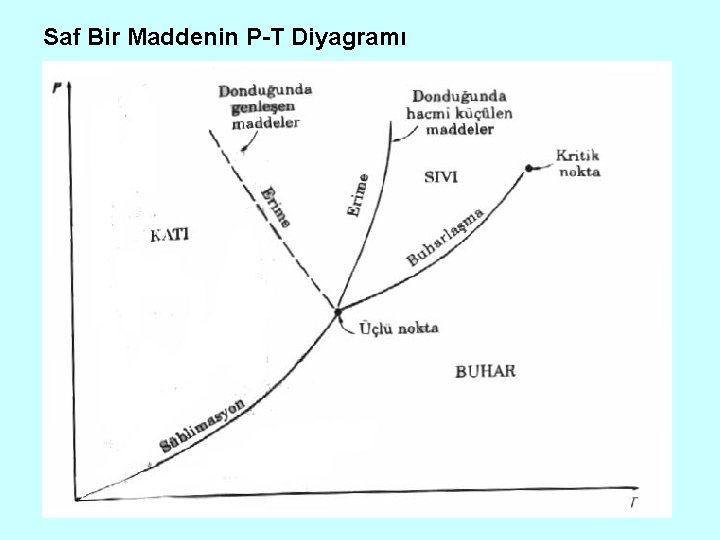
Saf Bir Maddenin P-T Diyagramı

TERMODİNAMİK Termodinamiğin Tanımı Enerji ve kuvvet uygulanmış cisimlerin incelenmesi anlamına gelen Termodinamik fiziğin ısı ile enerji arasındaki bağlantılarını inceleyen ve enerjinin şekil değiştirmesi ile uğraşan kolu olarak tanımlanır. Termodinamikte bir maddeye iş veya ısı verdiğimiz zaman maddenin hal değiştirmesi için, maddeye ne kadar iş veya ısı verilmesi veya alınması gerektiği hesaplanır. Termodinamikte diğer bir hedef de ısının ise çevrilmesi yöntemleri ve düşük sıcaklık kaynağından yüksek sıcaklık kaynağına ısı nakletmek için ne kadarlık bir iş verilmesi gerektiğini tespit etmektir.

TERMODİNAMİKTE KULLANILAN KAVRAMLAR Termodinamik Sistem Kavramı belirli bir kütleyi veya uzayın incelenmek üzere ayrılan bir bölgesini belirtir. Çevre Sistemin dışında kalan kütle veya bölgedir. Sınır Sistemi çevresinden ayıran gerçek veya hayali yüzeydir. Sistemin sınırları hareketli veya sabit olabilir. Sınır, sistem ile çevresinin ortak temas ettiği yüzey olarakta tanımlanabilir. Matematiksel açıdan, sınırın kalınlığı sıfırdır, bu nedenle kütlesi ve hacmi yoktur.

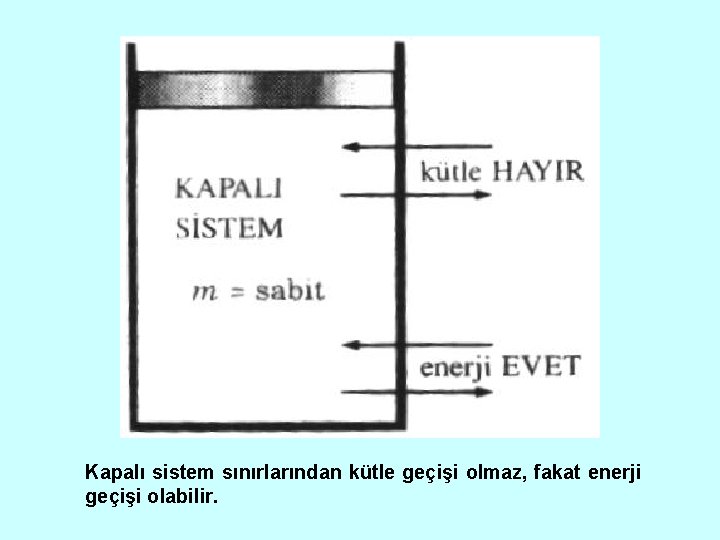
Sistem, çevre ve sınırın resim üzerinde gösterilmesi. Kapalı Sistem (Kontrol kütlesi) Şekilde görüldüğü gibi kapalı sistemde kütle giriş çıkışı olamaz. Enerji iş veya ısı şeklinde kapalı sistemin sınırlarından geçebilir. Kapalı sistem hacminin sabit olması gerekmez.

Kapalı sistem sınırlarından kütle geçişi olmaz, fakat enerji geçişi olabilir.

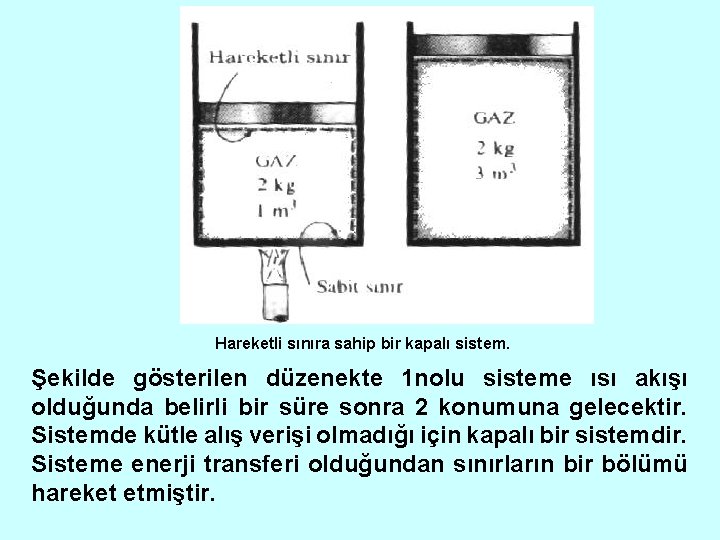
Hareketli sınıra sahip bir kapalı sistem. Şekilde gösterilen düzenekte 1 nolu sisteme ısı akışı olduğunda belirli bir süre sonra 2 konumuna gelecektir. Sistemde kütle alış verişi olmadığı için kapalı bir sistemdir. Sisteme enerji transferi olduğundan sınırların bir bölümü hareket etmiştir.

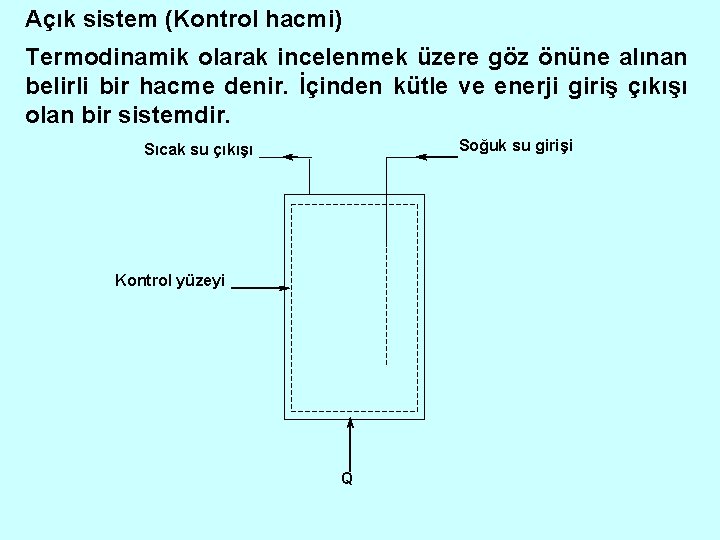
Açık sistem (Kontrol hacmi) Termodinamik olarak incelenmek üzere göz önüne alınan belirli bir hacme denir. İçinden kütle ve enerji giriş çıkışı olan bir sistemdir. Soğuk su girişi Sıcak su çıkışı Kontrol yüzeyi Q

Şekilde termosifonda sürekli su giriş ve çıkışı olmaktadır. Q ısı kaynağından termosifondaki suya ne kadar ısı taşınımı olduğunu bulmak için sabit kütleyi seçmek doğru olmaz. Bunun yerine kontrol hacmine giren sıcak ve soğuk su akışlarını çıkan kütleler alarak suya taşınan ısı miktarını bulabiliriz. Ayrık (İzole) Sistem Sınırlarından enerji ve kütle geçişi olmayan sistemdir. Ayrık sistem üzerinden çevrenin hiçbir tesiri olmadığı kabul edilecektir.

Adyabatik Sistem Bir hal değişimi iki şekilde adyabatik olabilir ya sistem çok iyi yalıtılmıştır dolayısıyla sınırlarından ancak ihmal edilebilir. Ölçülerde ısı geçebilir, yada sistem ve çevresi aynı sıcaklıktadır ve bu nedenle ısı geçişine etken olacak sıcaklık farkı yoktur. Adyabatik bir hal değişimi sırasında sistemle çevresi arsında ısı geçişi olmaz

Tersinirlik Geri Dönüşebilirlik Denge durumundaki bir sistem herhangi bir etkiyle hal değiştirdikten sonra hem sistemi hem de çevresini başlangıçtaki denge haline, getiriyorsa yapılan işlem tersinir bir işlemdir. F 1 P 1, V 1 F 21 PP 1 V 1 2, V 2 a b Şekil a. b Tersinir bir işleme örnek Şekil a’daki F 1 kuvvetinin şiddeti küçültür. Şekil b’deki konuma dönecek çevreyle ısı verişi ve sürtünme kuvveti olmadığı kabulüne göre F 2 kuvveti F 2−F 1 kadar artırılırsa yani F bir olursa sistem tekrar eski haline gelecektir.

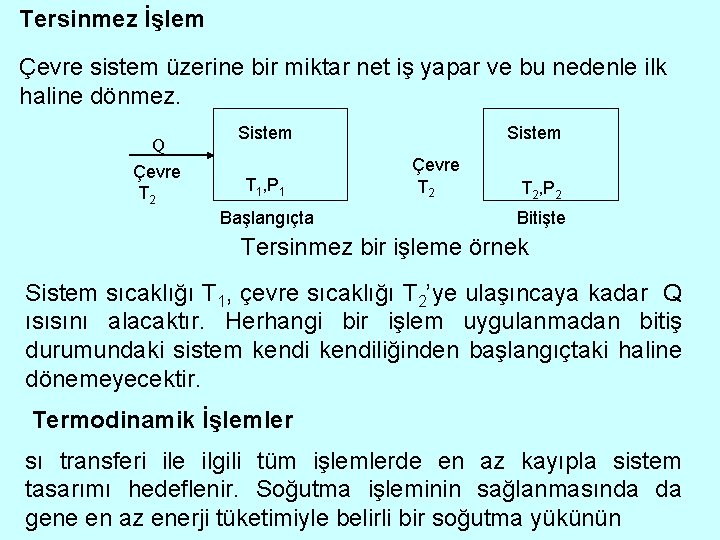
Tersinmez İşlem Çevre sistem üzerine bir miktar net iş yapar ve bu nedenle ilk haline dönmez. Q Çevre T 2 Sistem T 1, P 1 Başlangıçta Sistem Çevre T 2, P 2 Bitişte Tersinmez bir işleme örnek Sistem sıcaklığı T 1, çevre sıcaklığı T 2’ye ulaşıncaya kadar Q ısısını alacaktır. Herhangi bir işlem uygulanmadan bitiş durumundaki sistem kendiliğinden başlangıçtaki haline dönemeyecektir. Termodinamik İşlemler sı transferi ile ilgili tüm işlemlerde en az kayıpla sistem tasarımı hedeflenir. Soğutma işleminin sağlanmasında da gene en az enerji tüketimiyle belirli bir soğutma yükünün

karşılanması istenir. Soğutma çevrimin meydana getiren her bir işlemin en az kayıpla ve en az enerji sarfıyla çalışması gerekir. Soğutma çevrimlerinde kullanılan bazı termodinamik işlemler aşağıda açıklanmıştır. Sabit Hacimde Termodinamik İşlem (İzometrik) Şekil a’da elektrikli rezistan kapalı hacimde bulunan gaz akışkana Q ısısı verilmiş, . Şekil b’de Wk işi verilmiş kapalı bir sistem olduğu için diyagramda görüldüğü gibi basıncın P 1’den P 2’ye çıkmasına neden olmuştur. P Q P 2 WK V=Sbt P 1 P-v Diyagramı V Sisteme verilen ısının ve işin kapalı bir sistemde basınç hacim ilişkisi

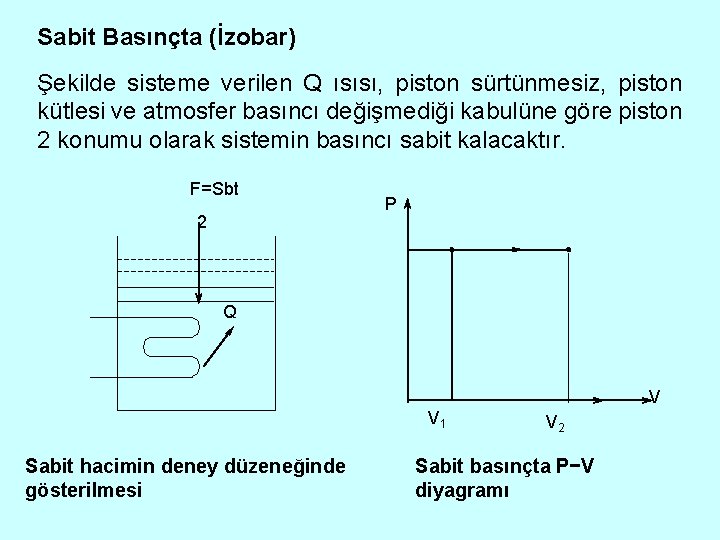
Sabit Basınçta (İzobar) Şekilde sisteme verilen Q ısısı, piston sürtünmesiz, piston kütlesi ve atmosfer basıncı değişmediği kabulüne göre piston 2 konumu olarak sistemin basıncı sabit kalacaktır. F=Sbt 2 P Q V V 1 Sabit hacimin deney düzeneğinde gösterilmesi V 2 Sabit basınçta P−V diyagramı

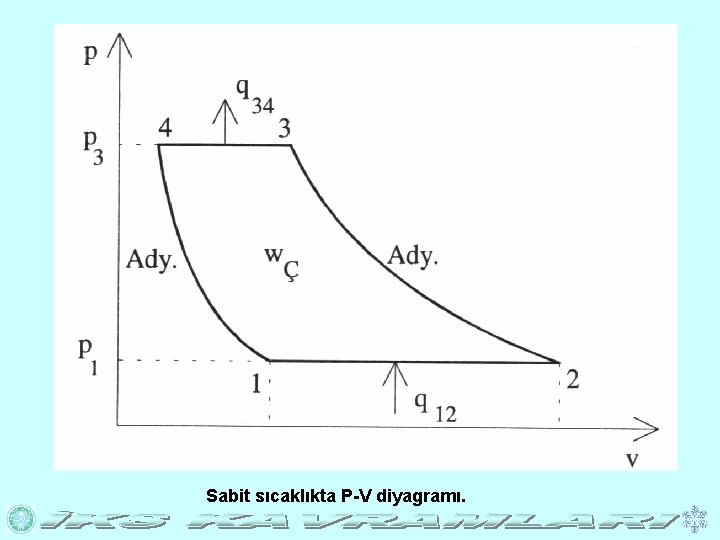
Sabit Sıcaklıkta (İzotermik) Aşağıdaki P. V diyagramında P 1 basıncında 1 -2 arası sabit basınçta olup sistem q 1, 2 ısısını alarak sabit sıcaklık ve basınç altında, P 3 basıncında ise 3 -4 arası sabit basınç altında olup sistem 3 noktasından itibaren q 3, 4 ısısını atmosfere transfer ederek 3 noktasından itibaren sabit sıcaklık ve basınç altında 4 noktasına kadar sıkıştırılmaktadır. P 1 basıncında 1 -2 arasında sabit sıcaklık ve basınç altındaki genişleme q 1, 2 ısısını alarak gazın halini değiştirmekte, P 3 basıncında 3 -4 arasındaki sabit sıcaklık ve basınç altındaki sıkıştırma q 3 -4 ısısını atmosfere transfer edip 4 noktasındaki. gazın halini değiştirmektedir. Soğutma çevrimlerinde olduğu gibi.

Sabit sıcaklıkta P-V diyagramı.

Sabit Entropi (İzentropik) Veya Geri Dönüşebilir Adyabatik P-V ve T-S diyagramlarında görüleceği üzere sistem P 1’’den P 2’’ye kadar sıkıştırma işlemine tabii tutulursa hacmi V 2 -V 1 kadar küçülmekte sıcaklığı T 1’den T 2’ye çıkmakta fakat sistemin entropisi sabit kalmaktadır. P T P 2 2 3 1 4 S=Sabit P 1 V V 2 V 1 S S 1 S 2 İzentropik işlemin P-V ve T-S diyagramında gösterilmesi
 özkütle farkı ile ayırma
özkütle farkı ile ayırma Turşusu
Turşusu Elementlerin sembolleri ve kullanım alanları
Elementlerin sembolleri ve kullanım alanları Saf madde sembolleri
Saf madde sembolleri Koligatif özellikler osmotik basınç
Koligatif özellikler osmotik basınç Saf madde nedir
Saf madde nedir Atom
Atom Ayn rand background
Ayn rand background Ayn rand ethical egoism
Ayn rand ethical egoism Ayn rand facts
Ayn rand facts Ayn rand born
Ayn rand born Ayn rand music
Ayn rand music Ayn harfi
Ayn harfi Ayn rand childhood
Ayn rand childhood Saydam madde ve opak madde nedir
Saydam madde ve opak madde nedir Madde zorluk indeksi
Madde zorluk indeksi Her madde zehirdir
Her madde zehirdir Merkürializm
Merkürializm Purple fountains romeo and juliet
Purple fountains romeo and juliet Her family calls her blessed
Her family calls her blessed Who wrote a song of a mother to her firstborn
Who wrote a song of a mother to her firstborn Theme in a story meaning
Theme in a story meaning Ubiquitous computing nedir
Ubiquitous computing nedir When katie clean invited messy missy
When katie clean invited messy missy Sheryl forgot her purse so i lent her ten dollars
Sheryl forgot her purse so i lent her ten dollars Her fancy was running riot along those days ahead of her
Her fancy was running riot along those days ahead of her Hyperbole examples about love
Hyperbole examples about love They will call her blessed
They will call her blessed Yaşa göre testis boyutları
Yaşa göre testis boyutları Saf
Saf Saf par
Saf par