lyosfra vrstva kapaliny kter lp na pevnm povrchu










- Slides: 13



lyosféra – vrstva kapaliny, která lpí na pevném povrchu Experimentální stanovení adsorpce z kapalné fáze na pevných látkách Povaha adsorbovaných vrstev fyzikální adsorpce, chemisorpce adsorpce molekulární, iontová

Hmotnostní bilance adsorpce Látkové množství roztoku n 0, které připadá na 1 g tuhé látky se po ustavení adsorpční rovnováhy rozdělí mezi roztok (nroztok) a adsorbovanou vrstvu (ns): Î Látkové množství rozpuštěné látky (složka 2) se rozdělí:

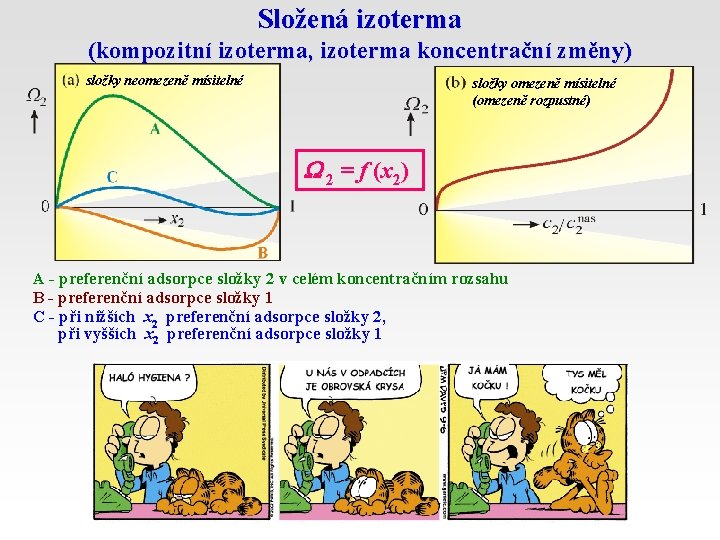
Složená izoterma (kompozitní izoterma, izoterma koncentrační změny) složky neomezeně mísitelné složky omezeně mísitelné (omezeně rozpustné) 2 = f (x 2) A - preferenční adsorpce složky 2 v celém koncentračním rozsahu B - preferenční adsorpce složky 1 C - při nižších x 2 preferenční adsorpce složky 2, při vyšších x 2 preferenční adsorpce složky 1

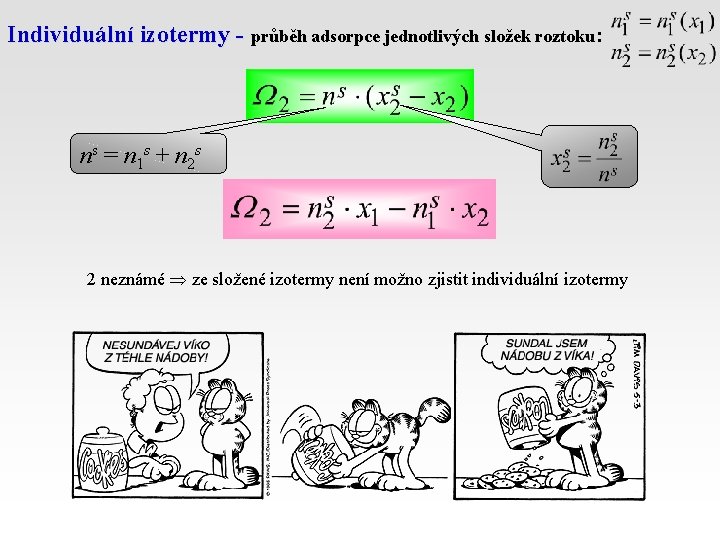
Individuální izotermy - průběh adsorpce jednotlivých složek roztoku: ns = n 1 s + n 2 s 2 neznámé ze složené izotermy není možno zjistit individuální izotermy

Analytické vyjádření složených izoterem Freundlich: Langmuir: 2 = A x 2α x 1 – B x 1β x 2

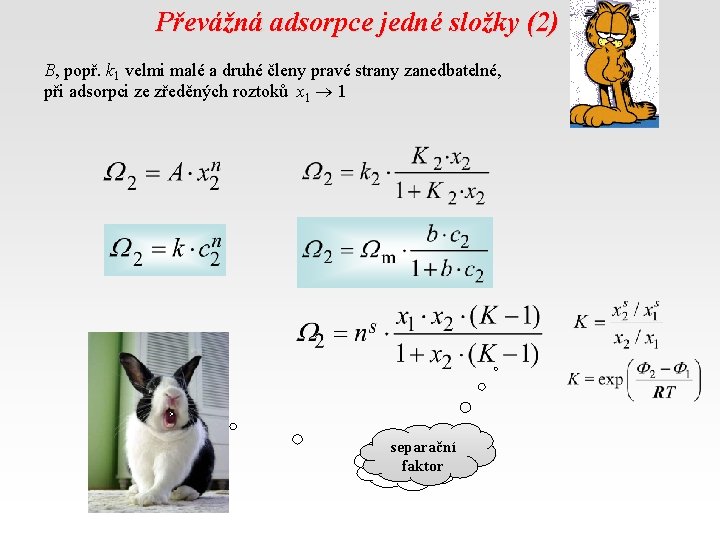
Převážná adsorpce jedné složky (2) B, popř. k 1 velmi malé a druhé členy pravé strany zanedbatelné, při adsorpci ze zředěných roztoků x 1 1 separační faktor

Vztahy mezi adsorptivitou a vlastnostmi systému adsorptivita a polarita, tzn. chemická struktura adsorbátu a adsorbentu polární látky - na polárních adsorbentech - z nepolárních rozpouštědel (např. voda z organických rozpouštědel na silikagelu) nepolární látky- na nepolárních adsorbentech - z polárních rozpouštědel (např. organické látky z vodných roztoků na aktivním uhlí) závislost adsorbovatelnosti na počtu uhlíků v homologických řadách: Traubeho pravidlo: adsorpce z vodného roztoku na nepolárních adsorbentech - adsorbované množství organické látky stoupá s počtem uhlíkových atomů v uhlovodíkovém řetězci (vyšší org. kyseliny méně polární) Obrácené Traubeho pravidlo: adsorpce z vodného roztoku na polárních adsorbentech (nižší - polárnější kyseliny se adsorbují více)

adsorptivita a vzájemná rozpustnost složek roztoku z rozpouštědla, které se málo adsorbuje, je rozpuštěná látka tím více adsorbovaná, čím méně je v daném rozpouštědle rozpustná velikost a tvar adsorbovaných molekul důležité hlavně při adsorpci na mikroporézních adsorbentech je-li průměr pórů je srovnatelný s velikostí částic jedné nebo obou složek roztoku, může být omezen přístup některého druhu molekul

adsorpce jednoho iontu, která není provázena jiným pochodem, povrch adsorbentu získává elektrický náboj nejčastěji na povrchu krystalické mřížky málo rozpustných iontových sloučenin (většinou solí a hydroxidů) z vodných roztoků elektrolytů. vzniká elektrická dvojvrstva (elektrostatické i adsorpční síly ) Panethovo-Fajansovo pravidlo Ionty z roztoku se adsorbují na povrchu krystalické mřížky tehdy, když tvoří s opačně nabitým iontem mřížky málo rozpustnou sloučeninu. Nejlépe se adsorbuje iont, který je sám součástí mřížky, nebo je některému z iontů mřížky podobný. Adsorbovatelnost stoupá s nábojem iontu a s jejich poloměrem; čím větší je poloměr iontu, tím menší je jeho hydratace při stejném náboji a hydratace je pro adsorpci značnou překážkou.

současně s adsorpcí iontu probíhá další děj, náboj adsorbentu pak zůstává nezměněn z jeho krystalové mřížky za ionty adsorbované z roztoku vysílá adsorbent ionty Ad. B + C+ = Ad. C z vnější části elektrické dvojvrstvy + B+ výměnná kapacita - množství iontů, které je schopna vyměnit jednotka hmotnosti suchého adsorbentu měniče iontů, ionexy - látky o velké výměnné kapacitě, přirozené (minerály typu zeolitů), syntetické organické i anorganické, Součástí jejich mřížky jsou pravidelně rozmístěné velmi úzké póry. Malé ionty tak mohou pronikat dovnitř a výměna probíhá na vnitřním povrchu adsorbentu. Vnější povrch je u těchto adsorbentů proti povrchu vnitřnímu zanedbatelně malý a výměnná kapacita nezávisí na velikosti vnějšího povrchu ani na stupni disperzity.

speciální případ iontové adsorpce na aktivním uhlí Určitým způsobem připravené aktivní uhlí adsorbuje z roztoků podle způsobu přípravy buď jenom kyselou nebo jenom zásaditou složku. Jestliže se jedná o adsorpci z roztoku soli, probíhá pochod tak, jako by se sůl vlivem adsorbentu hydrolyzovala. Např. na aktivním uhlí, připraveném zuhelněním čisté sacharózy za omezeného přístupu vzduchu proběhne adsorpce z roztoku KCl podle rovnice Ad + Cl– + K+ + H 2 O Ad. HCl + OH– + K+ Výsledný děj: molekulární adsorpce kyseliny Stejně připravené uhlí, zahřáté ještě v proudu vodíku bude naopak vázat KOH: Ad + Cl– + K+ + 2 H 2 O Ad. KOH + H 3 O+ + Cl– Výsledný děj: molekulární adsorpce hydroxidu
 Závislost hustoty kapaliny na teplotě
Závislost hustoty kapaliny na teplotě Jevy na rozhraní pevného tělesa a kapaliny
Jevy na rozhraní pevného tělesa a kapaliny Struktura a vlastnosti kapalin příklady
Struktura a vlastnosti kapalin příklady Struktura a vlastnosti kapalin
Struktura a vlastnosti kapalin Nejhustší kapalina
Nejhustší kapalina Jaký tlak má vzduch v kulové bublině o průměru
Jaký tlak má vzduch v kulové bublině o průměru Googleped
Googleped Nejhustší kapalina
Nejhustší kapalina Těleso ponořené do kapaliny je nadlehčováno
Těleso ponořené do kapaliny je nadlehčováno Bod na zemském povrchu nad ohniskem zemětřesení
Bod na zemském povrchu nad ohniskem zemětřesení Obvod krychle
Obvod krychle Povrch kvadra
Povrch kvadra Co je na povrchu svalu
Co je na povrchu svalu Sloen
Sloen