Katera Chemii Nieorganicznej i Analitycznej U Ul Tamka















- Slides: 30

Katera Chemii Nieorganicznej i Analitycznej UŁ Ul. Tamka 12, 91 -403 Łódź

Plan prezentacji Procesy elektrodowe 1. Współczynniki przejścia elektronu 2. Procesy odwracalne i nieodwracalne 3. Elektrokataliza i inhibicja 4. Zarodkowanie i wzrost warstw 5. Wybrane procesy elektrochemiczne

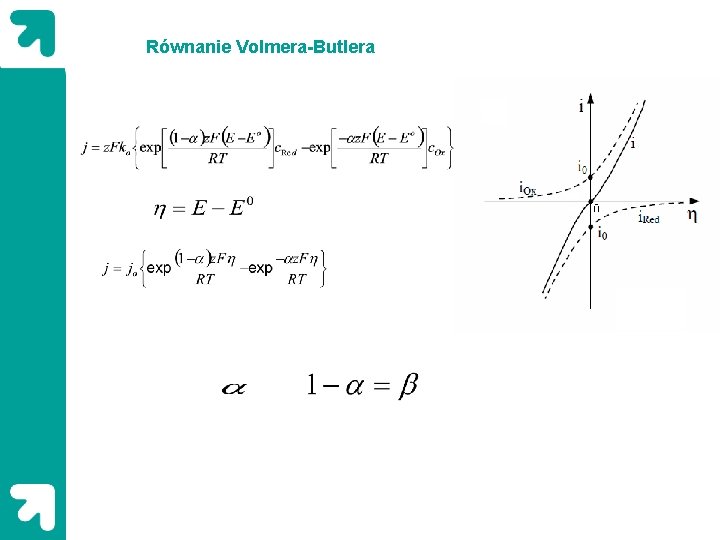
Równanie Volmera-Butlera

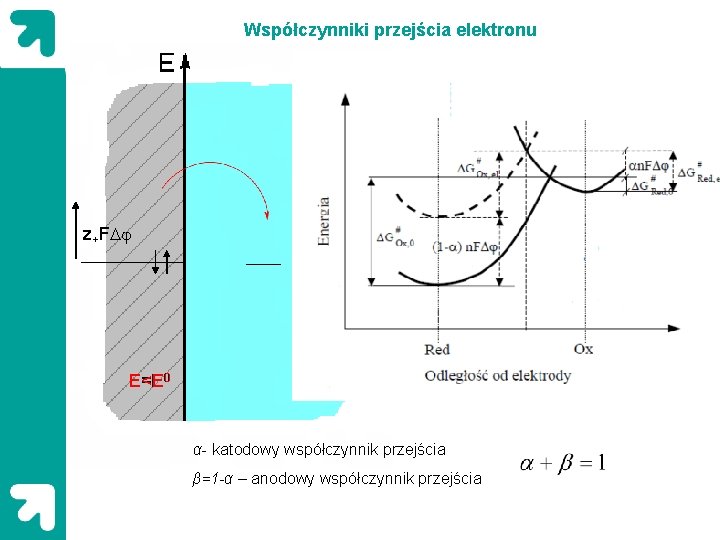
Współczynniki przejścia elektronu z+FDj E=E E<E 0 α- katodowy współczynnik przejścia β=1 -α – anodowy współczynnik przejścia

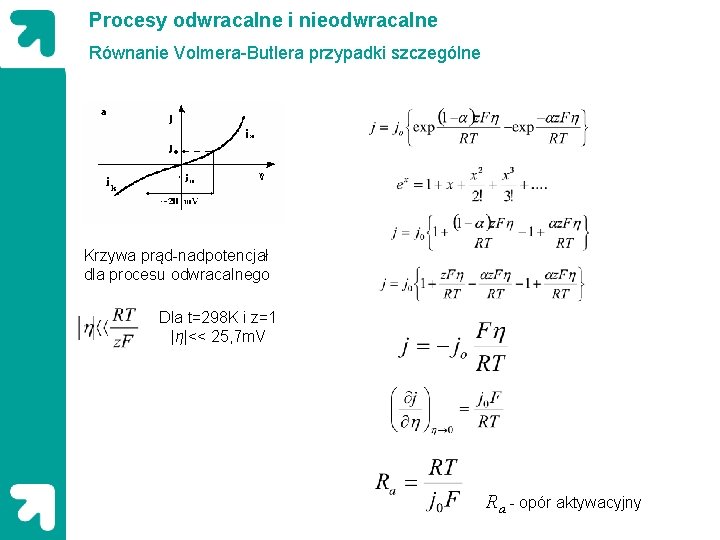
Procesy odwracalne i nieodwracalne Równanie Volmera-Butlera przypadki szczególne Krzywa prąd-nadpotencjał dla procesu odwracalnego Dla t=298 K i z=1 |η|<< 25, 7 m. V Ra - opór aktywacyjny

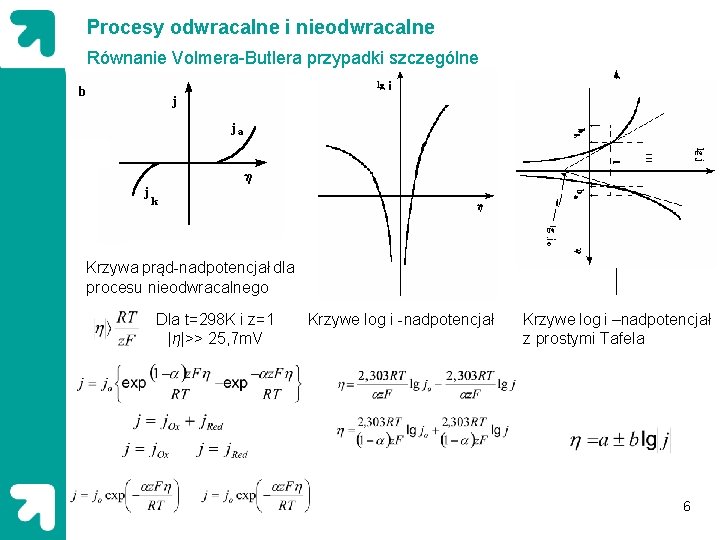
Procesy odwracalne i nieodwracalne Równanie Volmera-Butlera przypadki szczególne Krzywa prąd-nadpotencjał dla procesu nieodwracalnego Dla t=298 K i z=1 |η|>> 25, 7 m. V Krzywe log i -nadpotencjał Krzywe log i –nadpotencjał z prostymi Tafela 6

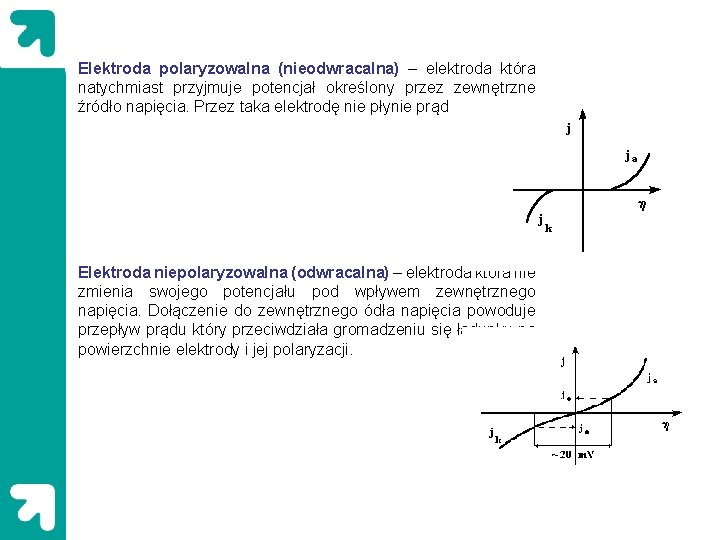
Elektroda polaryzowalna (nieodwracalna) – elektroda która natychmiast przyjmuje potencjał określony przez zewnętrzne źródło napięcia. Przez taka elektrodę nie płynie prąd Elektroda niepolaryzowalna (odwracalna) – elektroda która nie zmienia swojego potencjału pod wpływem zewnętrznego napięcia. Dołączenie do zewnętrznego ódła napięcia powoduje przepływ prądu który przeciwdziała gromadzeniu się ładunku na powierzchnie elektrody i jej polaryzacji.

Elektrokataliza i inhibicja Adsorbcja fizyczna i chemisorbcja Adsorbcja fizyczna w małym stopniu zależy od materiału elektrody w dużym stopniu zależy od potencjału elektrody. Chemisorbcja proces w którym między substancją adsorbowaną a podłożem tworzą się wiązania chemiczne, limituje to powstawanie jedynie monowarstw. Chemisorbcja w dużym stopniu zależy od materiału elektrody a w nieznacznym od potencjału elektrody. M + H+(aq) + e ⇄ M-H 2 M-H → M·H 2 M-H + H+(aq) + e → M·H 2→ M + H 2(g) 8

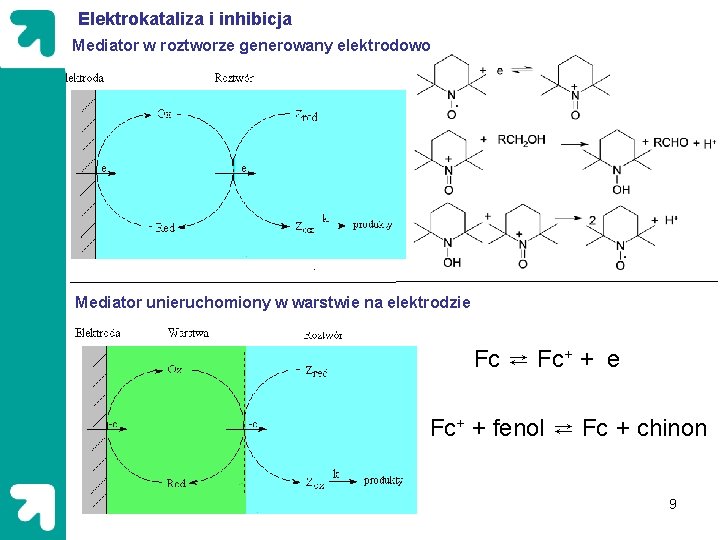
Elektrokataliza i inhibicja Mediator w roztworze generowany elektrodowo Mediator unieruchomiony w warstwie na elektrodzie Fc ⇄ Fc+ + e Fc+ + fenol ⇄ Fc + chinon 9

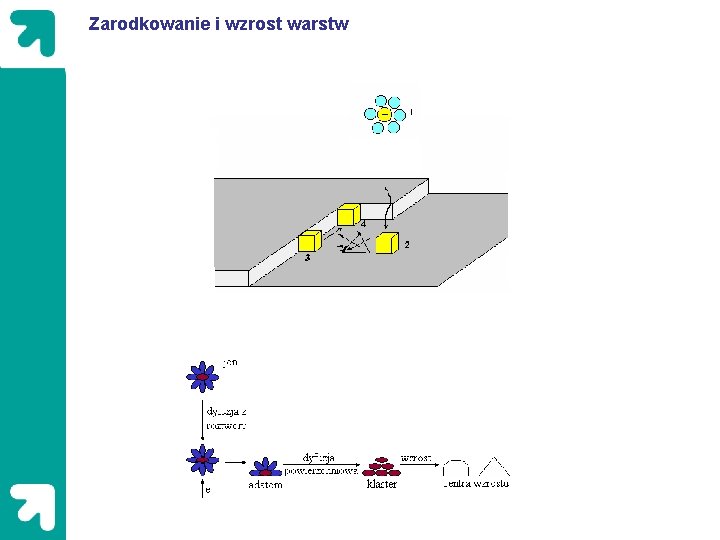
Zarodkowanie i wzrost warstw

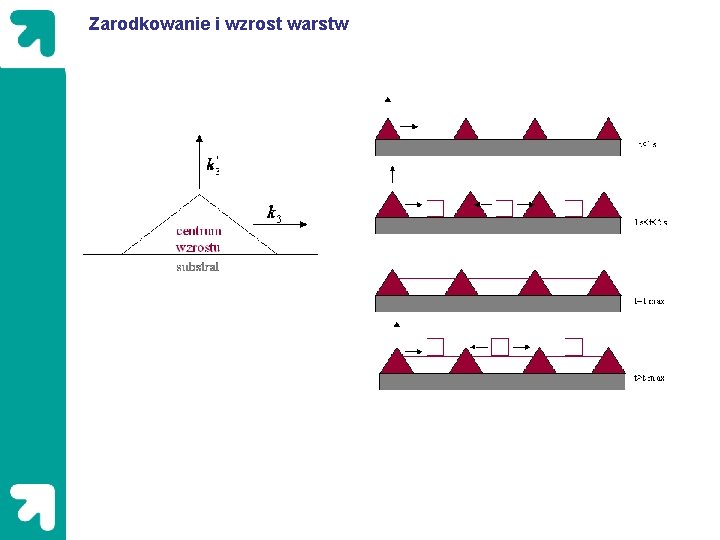
Zarodkowanie i wzrost warstw

Wybrane procesy elektrochemiczne Przemysłowe zastosowania elektrochemii Otrzymywanie niektórych gazów Otrzymywanie metali i stopów Oczyszczanie metali Elektrosynteza związków nieorganicznych Elektroliza stopionych soli Elektroliza roztworów wodnych Galwanotechnika

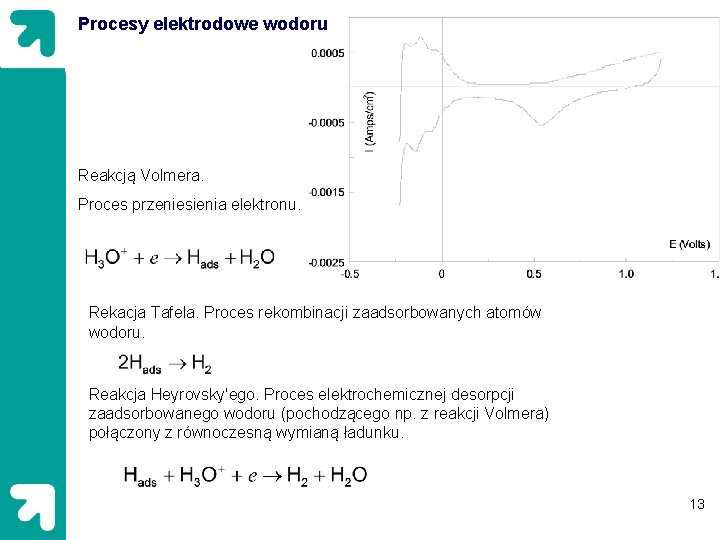
Procesy elektrodowe wodoru Reakcją Volmera. Proces przeniesienia elektronu. Rekacja Tafela. Proces rekombinacji zaadsorbowanych atomów wodoru. Reakcja Heyrovsky'ego. Proces elektrochemicznej desorpcji zaadsorbowanego wodoru (pochodzącego np. z reakcji Volmera) połączony z równoczesną wymianą ładunku. 13

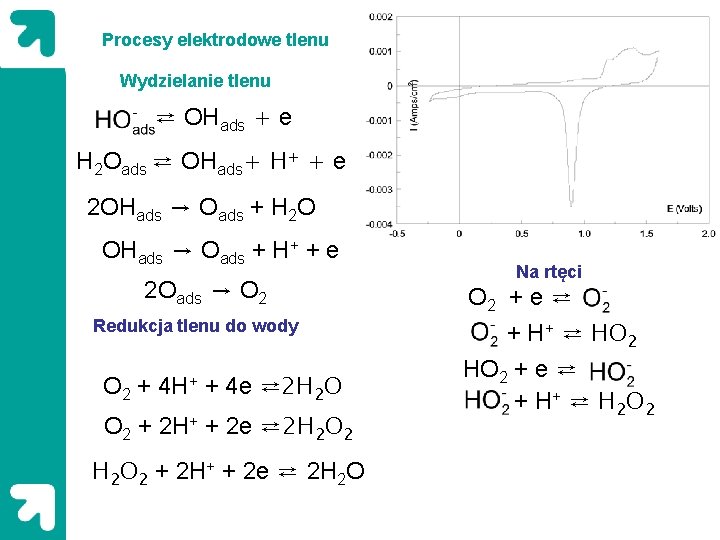
Procesy elektrodowe tlenu Wydzielanie tlenu ⇄ OHads + e H 2 Oads ⇄ OHads+ H+ + e 2 OHads → Oads + H 2 O OHads → Oads + H+ + e 2 Oads → O 2 Redukcja tlenu do wody O 2 + 4 H+ + 4 e ⇄2 H 2 O O 2 + 2 H+ + 2 e ⇄2 H 2 O 2 + 2 H+ + 2 e ⇄ 2 H 2 O Na rtęci O 2 + e ⇄ + H+ ⇄ HO 2 + e ⇄ + H + ⇄ H 2 O 2

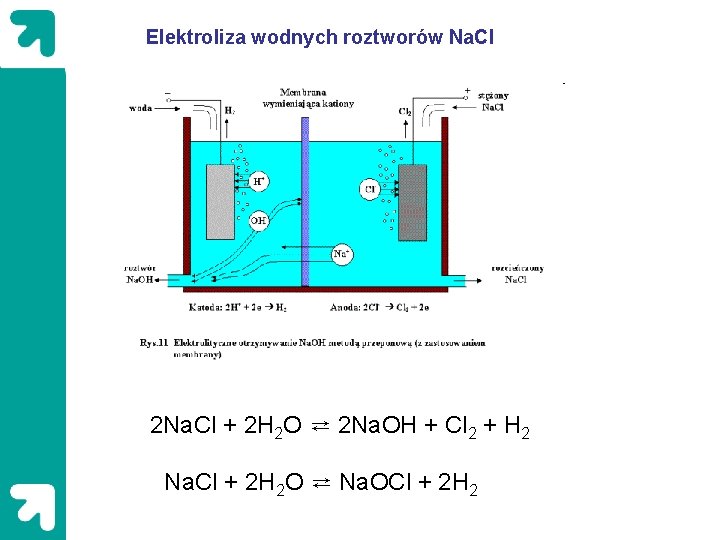
Elektroliza wodnych roztworów Na. Cl 2 Na. Cl + 2 H 2 O ⇄ 2 Na. OH + Cl 2 + H 2 Na. Cl + 2 H 2 O ⇄ Na. OCl + 2 H 2

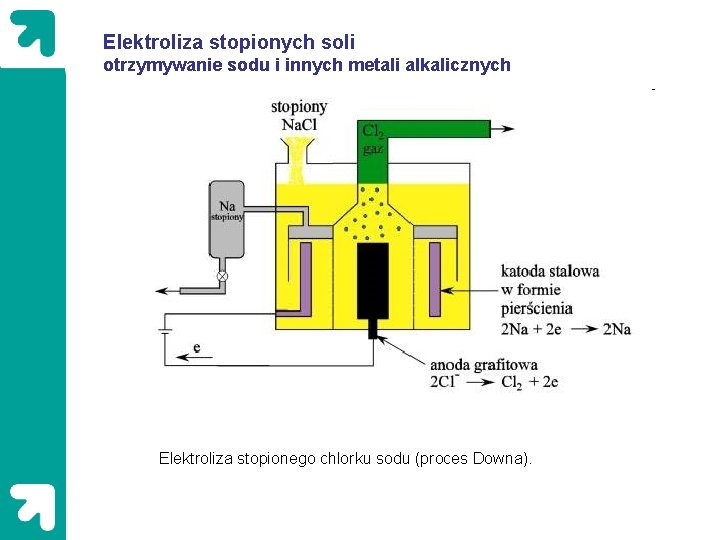
Elektroliza stopionych soli otrzymywanie sodu i innych metali alkalicznych Sole stopione, należąc do klasy przewodników elektrolitycznych, dobrze przewodzą prąd elektryczny. Podczas ich elektrolizy na anodzie i katodzie wydzielają się produkty ich rozkładu podobnie jak w przypadku elektrolizy roztworów wodnych. Tak więc z Pb. Cl 2 otrzymuje się ołów oraz chlor, z Na. Cl – sód i chlor, z Na. NO 3 – sód oraz tlen i tlenki azotu. Przewodnictwo soli w stanie stopionym jest znacznie większe niż ich roztworów wodnych. Metodę tą stosuje się, gdy nie można przeprowadzić elektrolizy wodnych roztworów tych soli, gdyż produkty po wydzieleniu reagują z wodą, albo też gdy rudy wykorzystywane do elektrolitycznego otrzymywania metali są w wodzie trudno rozpuszczalne (np. Al 2 O 3). Na skalę przemysłową metodą tą otrzymuje się między innymi glin, sód, lit i magnez

Elektroliza stopionych soli otrzymywanie sodu i innych metali alkalicznych Elektroliza stopionego chlorku sodu (proces Downa).

Elektroliza stopionych soli otrzymywanie magnezu Źródłem chlorku magnezu są naturalne solanki, woda morska, karnalit lub dolomit. Po przeróbce chemicznej surowców otrzymuje się uwodniony Mg. Cl 2, którym zasila się elektrolizery. Proces jest prowadzony w temperaturze ok. 700 o. C. Ciekły magnez, o mniejszej gęstości niż elektrolit, zbiera się na jego powierzchni. Na anodzie wydziela się równoważna ilość chloru. Reakcja zachodzi zgodnie z równaniem: Mg. Cl 2 → Mg + Cl 2 Zastosowanie: • surowiec do produkcji stopów (przemysł lotniczy) • materiał konstrukcyjny do wanien elektrolitycznych • produkcja ogni sztucznych

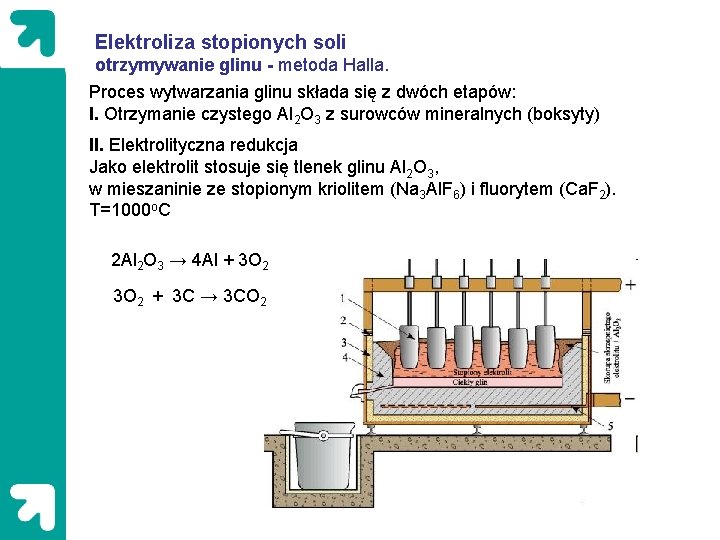
Elektroliza stopionych soli otrzymywanie glinu - metoda Halla. Proces wytwarzania glinu składa się z dwóch etapów: I. Otrzymanie czystego Al 2 O 3 z surowców mineralnych (boksyty) II. Elektrolityczna redukcja Jako elektrolit stosuje się tlenek glinu Al 2 O 3, w mieszaninie ze stopionym kriolitem (Na 3 Al. F 6) i fluorytem (Ca. F 2). T=1000 o. C 2 Al 2 O 3 → 4 Al + 3 O 2 + 3 C → 3 CO 2

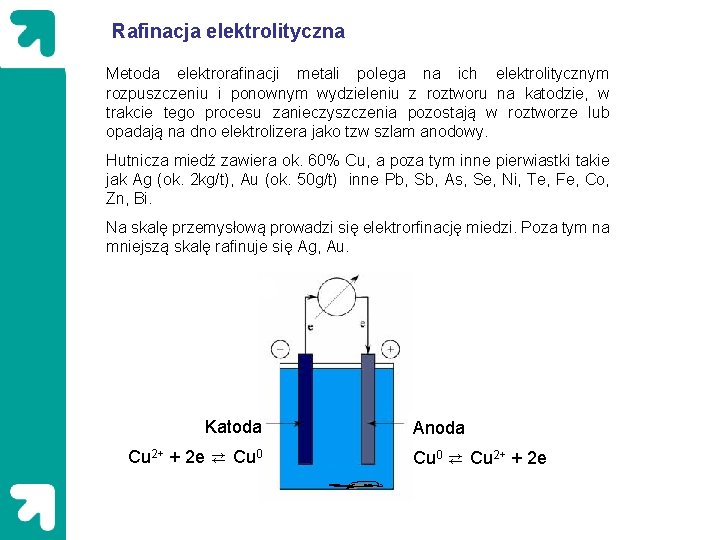
Rafinacja elektrolityczna Metoda elektrorafinacji metali polega na ich elektrolitycznym rozpuszczeniu i ponownym wydzieleniu z roztworu na katodzie, w trakcie tego procesu zanieczyszczenia pozostają w roztworze lub opadają na dno elektrolizera jako tzw szlam anodowy. Hutnicza miedź zawiera ok. 60% Cu, a poza tym inne pierwiastki takie jak Ag (ok. 2 kg/t), Au (ok. 50 g/t) inne Pb, Sb, As, Se, Ni, Te, Fe, Co, Zn, Bi. Na skalę przemysłową prowadzi się elektrorfinację miedzi. Poza tym na mniejszą skalę rafinuje się Ag, Au. Katoda Cu 2+ + 2 e ⇄ Cu 0 Anoda Cu 0 ⇄ Cu 2+ + 2 e

Rafinacja elektrolityczna miedzi Celem elektrolitycznej rafinacji miedzi jest usunięcie pozostałych zanieczyszczeń i otrzymanie miedzi wysokiej czystości 99, 99%. Proces prowadzi się w betonowych wannach wyłożonych ołowiem, w których na przemian zawiesza się miedziane anody uzyskane w procesie rafinacji ogniowej i cienkie katody z miedzi elektrolitycznej, na których osadza się miedź w procesie rafinacji. Jako elektrolit stosuje się 15% wodny roztwór H 2 SO 4, zawierający ok. 23% Cu. SO 4. Proces prowadzi się w temp. 500 C, gęstość prądu wynosi 200 A/dm 2. Metale bardziej elektrododatnie rozpuszczają się i opadając na dno tworzą szlam. Produkcja hut w KGHM Polska Miedź S. A. 21

Rafinacja elektrolityczna miedzi 22

Rafinacja elektrolityczna srebra Srebro otrzymuje się głównie z koncentratów ze szlamu anodowego z rafinerii miedzi, a także z rafinerii innych metali nieżelaznych jak ołów, nikiel i cynk. Często stosuje się rafinację metodą Mőbiusa. Jako katody stosuje się blachy srebrne i aluminiowe. Anody stanowią blachy z surowego srebra. Jako elektrolit używa się 1 -6% roztwór Ag. NO 3. Gęstość prądu wynosi 430 -650 A/dm 2 powierzchni anody 280 -380 A/dm 2 katody. 23

Rafinacja elektrolityczna złota Proces polega na prowadzeniu elektrolizy w gorącym, kwaśnym roztworze chlorku złota z anodami wykonanymi z poddawanego rafinacji metalu i katodami wykonanymi z cienkich wstęg walcowanego złota. Roztwór ma temperaturę 70 0 C i zawiera od 7 do 8% złota i 10% kwasu solnego. Gęstość elektrolitu wynosi 1, 30 g/cm 3.

Hydrometalurgia Otrzymywanie cynku, kadmu Cynk na skalę przemysłową otrzymuje się metodą pirometalurgiczną bądź hydrometalurgiczną. W procesie hydrometalurgicznym koncentrat poddaje się ługowaniu roztworem kwasu siarkowego (H 2 SO 4), otrzymany roztwór siarczanu cynku (Zn. SO 4) oczyszcza się, i wydziela się z niego metaliczny cynk drogą elektrolizy. Oczyszczany roztwór przechodzi do elektrolizerni, gdzie cynk jest otrzymywany elektolitycznie Stosuje się anody ołowiowane i katody aluminiowe. Cynk osadza się na katodach, a na anodach wytwarza się tlen (-) Zn 2+ + 2 e ⇄ Zn 0 (+) 2 H 2 O ⇄ 4 H+ + O 2 + 4 e Następnie okresowo zdziera się cynk z katod, przetapia i odlewa w tzw. gąski.

Hydrometalurgia Otrzymywanie cynku, kadmu Kadm jest produktem uboczny metalurgii cynku. Wytwarzany jest poprzez elektrolizę roztworu siarczanu (VI) kadmu (Cd. SO 4), (-) Cd 2+ + 2 e ⇄ Cd 0 (+) 2 H 2 O ⇄ 4 H+ + O 2 + 4 e Następnie kadm otrzymany elektrolitycznie poddawany jest destylacji pod zmniejszonym ciśnieniem w celu otrzymania czystego kadmu.

Elektrosynteza związków nieorganicznych Otrzymywanie chloranów (V) Otrzymywanie chloranów (VII) Otrzymywanie peroksodisiarczanu (VI) amonu

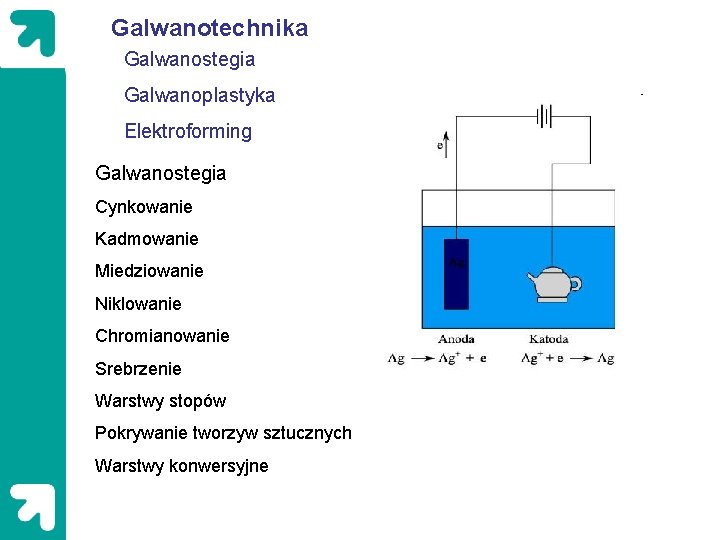
Galwanotechnika Galwanostegia Galwanoplastyka Elektroforming Galwanostegia Cynkowanie Kadmowanie Miedziowanie Niklowanie Chromianowanie Srebrzenie Warstwy stopów Pokrywanie tworzyw sztucznych Warstwy konwersyjne

Literatura 1. H. Scholl, T. Błaszczyk , P. Krzyczmonik, " Elektrochemia - Zarys teorii i praktyki", Wyd. U Ł , 1998 2. I. Koryta, I. Dvorak, V. Bohackowa, "Elektrochemia", PWN , 1980. 3. H. Scholl, Wykłady z elektrochemii, Łódź 4. W. Libuś, Z. Libuś, "Elektrochemia", PWN , 1987. 5. A. J. Bard, G. Inzelt, F. Scholz, Electrochemical Dictionary Springer, 2008 6. A. Kisza, Elektrochemia I, Jonika, WNT Warszawa, 2000 7. A. Kisza, Elektrochemia II, Elektrodyka, WNT Warszawa, 2001

Dziękuję za uwagę






























