Katera Chemii Nieorganicznej i Analitycznej Zakad Elektroanalizy i
















![Akumulatory litowo-jonowy, litowo-polimerowy Lix. GRAFIT + [MATRYCA-katoda] ⇄ [GRAFIT] + Lix. MATRYCA-katoda 31 Akumulatory litowo-jonowy, litowo-polimerowy Lix. GRAFIT + [MATRYCA-katoda] ⇄ [GRAFIT] + Lix. MATRYCA-katoda 31](https://slidetodoc.com/presentation_image_h/a1e7ac47bdd6099004f2849df776dbf1/image-31.jpg)




- Slides: 36

Katera Chemii Nieorganicznej i Analitycznej Zakład Elektroanalizy i Elektrochemii UŁ Ul. Tamka 12, 91 -403 Łódź 1

Plan dzisiejszego wykładu 1. Wstęp 2. Potencjał elektrody, równanie Nersta 3. Elektrody 4. Funkcje termodynamiczne ogniw galwanicznych 5. Metody pomiaru siły elektromotorycznaj (SEM) 6. Baterie, akumulatory i ogniwa paliwowe

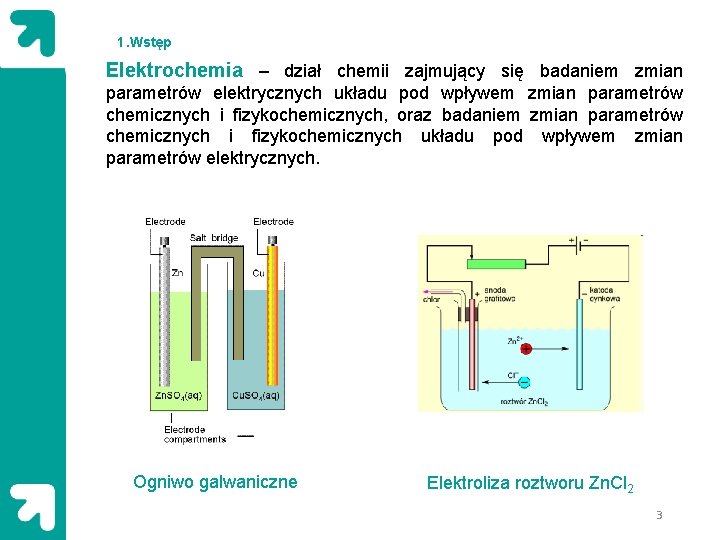
1. Wstęp Elektrochemia – dział chemii zajmujący się badaniem zmian parametrów elektrycznych układu pod wpływem zmian parametrów chemicznych i fizykochemicznych, oraz badaniem zmian parametrów chemicznych i fizykochemicznych układu pod wpływem zmian parametrów elektrycznych. Ogniwo galwaniczne Elektroliza roztworu Zn. Cl 2 3

1. Wstęp Przewodnik I-ego rodzaju-substancja zdolna do przewodzenia prądu elektrycznego w której przewodnictwo odbywa się poprzez ruch elektronów lub dziur po elektronach, inaczej przewodnik elektronowy. Metale, stopy, półprzewodniki, polimery z przewodnictwem elektronowym. Przewodnik II-egp rodzaju-substancja zdolna do przewodzenia prądu ejelektrycznego w którym przewodnictwo odbywa się poprzez ruch jonów, inaczej przewodnik jonowy. Roztwory elektrolitów, stopione sole, ciecze jonowe, polimery z przewodnictwem jonowym. Elektroda – w znaczeniu półogniwo - układ zbudowany z co najmniej dwóch faz będących w kontakcie ze sobą z których jedna jest przewodnikiem pierwszego rodzaju a druga, przewodnikiem drugiego rodzaju. - w znaczeniu kontaktu elektrycznego – przewodnik I-ego rodzaju zapewniający kontakt elektryczny układu na zewnątrz. 4

1. Wstęp Anoda – jest to elektroda na której zachodzą procesy utlenienia. Katoda – jest to elektroda na której zachodzą procesy redukcji. Potencjał elektrody – jest to siła elektromotoryczna (SEM) ogniwa galwanicznego zbudowanego z badanej elektrody i elektrody odniesienia. Dla elektrody odniesienia przyjmuje się potencjał równy 0 V. Warunki normalne — to ściśle określona temperatura i ciśnienie otoczenia, które stanowią rodzaj punktu odniesienia do niektórych obliczeń fizykochemicznych. • ciśnienie: p = 101325 Pa = 1013, 25 h. Pa = 1 atm • temperatura: T = 273, 15 K = 0°C Warunki standardowe – ściśle określona temperatura i ciśnienie otoczenia, które stanowią rodzaj punktu odniesienia do rozmaitych obliczeń fizykochemicznych. • ciśnienie: p = 1 bar = 1000 h. Pa • temperatura: T = 298, 15 K = 25°C 5

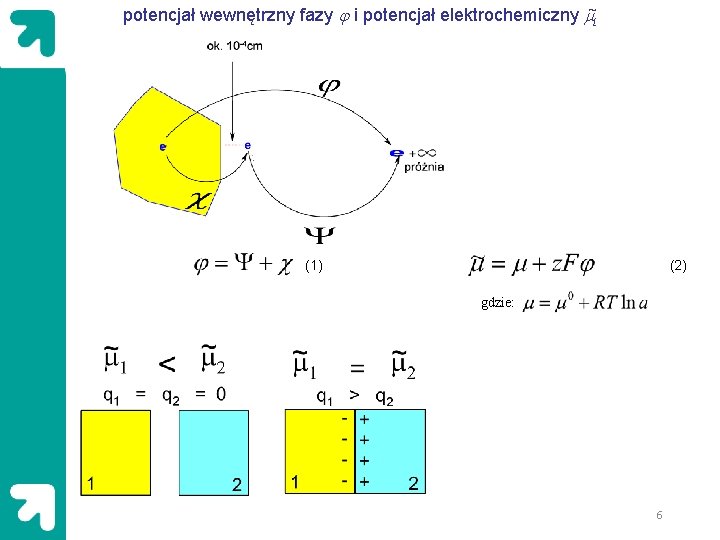
potencjał wewnętrzny fazy j i potencjał elektrochemiczny m~i (1) (2) gdzie: 6

potencjał wewnętrzny fazy j i potencjał elektrochemiczny mi (2) (3) (6) (7) (8) (4) (9) (5) (10) 7

Potencjał elektrody, równanie Nersta Pt | H 2 | HCl(c) | Ag. Cl(s) | Ag | Pt’ (12) Pt (e) | H 2 | HCl (H+, Cl-, Ag+) | Ag. Cl(Cl-, Ag+) | Ag ( Ag+, e) | Pt’ (e) 1 2 3 4 5 (13) 1’ (14) (15) ⇄ (16) (17) (18, 19) (20) (21) (22) 8

Potencjał elektrody, równanie Nersta (22) (23) (24) (25) (26) (27) Równanie Nersta 9

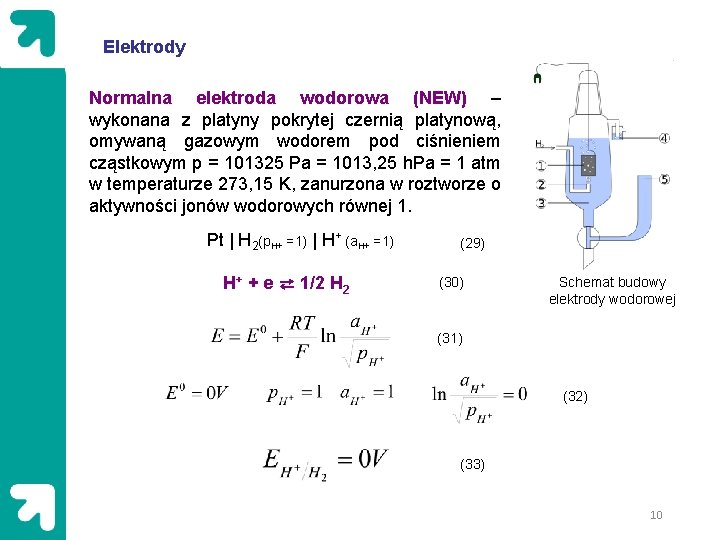
Elektrody Normalna elektroda wodorowa (NEW) – wykonana z platyny pokrytej czernią platynową, omywaną gazowym wodorem pod ciśnieniem cząstkowym p = 101325 Pa = 1013, 25 h. Pa = 1 atm w temperaturze 273, 15 K, zanurzona w roztworze o aktywności jonów wodorowych równej 1. Pt | H 2(p. H+ =1) | H+ (a. H+ =1) H+ + e ⇄ 1/2 H 2 (29) (30) Schemat budowy elektrody wodorowej (31) (32) (33) 10

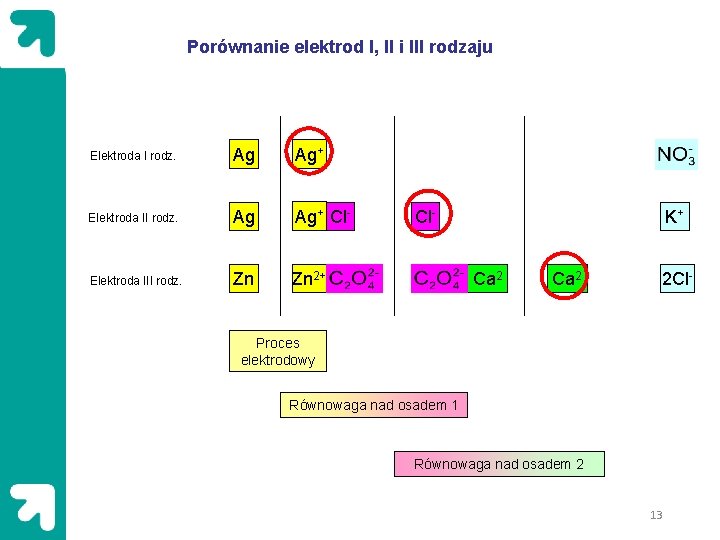
Elektrody I-ego rodzaju Ag(s)|Ag. NO 3(aq) (36) Ago ⇄ Ag+ + e Elektrody II-ego rodzaju (np. kalomelowa, chlorosrebrowa, siarczanowa) Ag(s)|Ag. Cl(s)|KCl(aq) Hg(l)|Hg. O(s)|Na. OH(aq) Hg(l)|Hg 2 Cl 2(s)|KCl(aq) Hg(l)|Hg. SO 4 (s)|H 2 SO 4(aq) Ag 0 ⇄ Ag+ + e Ag++ Cl- ⇄ Ag. Cl Ag 0 + Cl- ⇄ Ag. Cl+ e (37) (38) 11

Elektrody III-ego rodzaju Zn(s)| Zn. C 2 O 4(s), Ca. C 2 O 4(s)|Ca(NO 3)2(aq) Zn 0 ⇄ Zn 2+ + 2 e Zn. C 2 O 4 ⇄ Zn 2+ + C 2 O 4 Ca. C 2 O 4 ⇄ Ca 2+ + C 2 O 4 Zn 0 + Ca. C 2 O 4 ⇄ Zn. C 2 O 4 + Ca 2+ + 2 e (39) (40) Gdzie: (41) 12

Porównanie elektrod I, II i III rodzaju Elektroda I rodz. Ag Ag+ Elektroda II rodz. Ag Ag+ Cl- Elektroda III rodz. Zn Zn 2+ Cl- K+ Ca 2 2 Cl- Proces elektrodowy Równowaga nad osadem 1 Równowaga nad osadem 2 13

Elektrody Red-ox Fe 3+ / Fe 2+, Ce 4+ / Ce 3+ (42) Pt | Fe 3+, Fe 2+, Cl- potencjał formalny (43) Elektrody tlenkowe Elektroda antymonowa Sb(s)| Sb 2 O 3(s)| H+ Sb 2 O 3 + 6 H+ + 6 e ⇄2 Sb + 3 H 2 O (44) 14

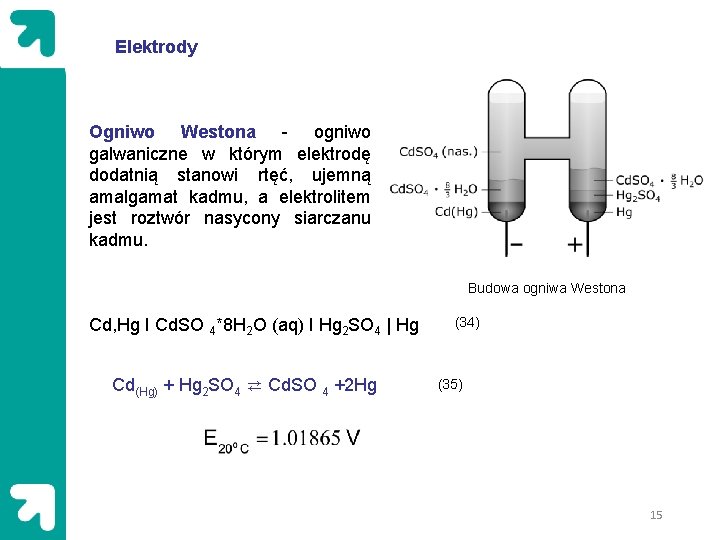
Elektrody Ogniwo Westona - ogniwo galwaniczne w którym elektrodę dodatnią stanowi rtęć, ujemną amalgamat kadmu, a elektrolitem jest roztwór nasycony siarczanu kadmu. Budowa ogniwa Westona Cd, Hg I Cd. SO 4*8 H 2 O (aq) I Hg 2 SO 4 | Hg Cd(Hg) + Hg 2 SO 4 ⇄ Cd. SO 4 +2 Hg (34) (35) 15

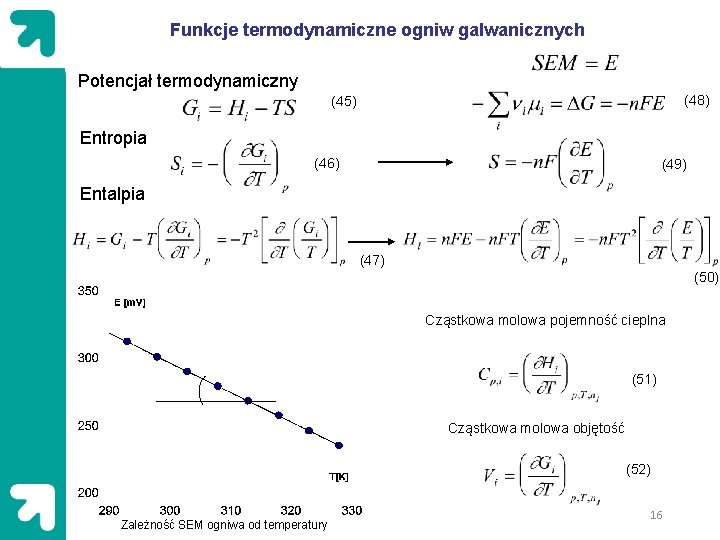
Funkcje termodynamiczne ogniw galwanicznych Potencjał termodynamiczny (48) (45) Entropia (46) (49) Entalpia (47) (50) Cząstkowa molowa pojemność cieplna (51) Cząstkowa molowa objętość (52) Zależność SEM ogniwa od temperatury 16

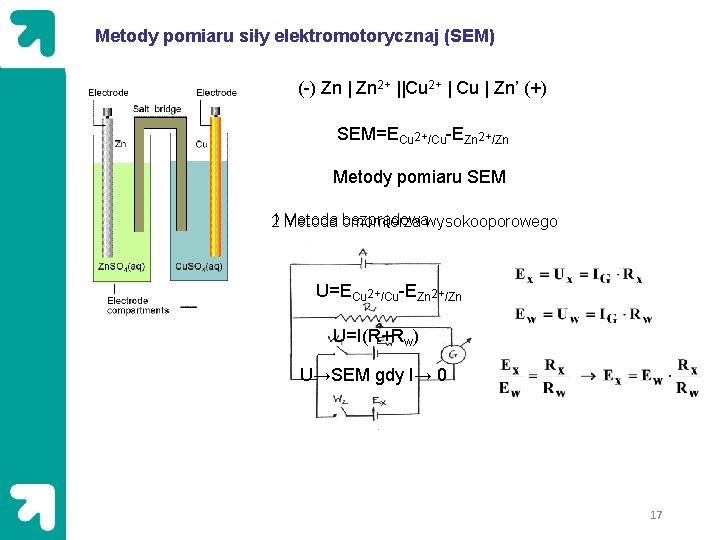
Metody pomiaru siły elektromotorycznaj (SEM) (-) Zn | Zn 2+ ||Cu 2+ | Cu | Zn’ (+) SEM=ECu 2+/Cu-EZn 2+/Zn Metody pomiaru SEM 1 Metoda omomierza bezprądowawysokooporowego 2 U=ECu 2+/Cu-EZn 2+/Zn U=I(R+Rw) U→SEM gdy I→ 0 17

Baterie, akumulatory i ogniwa paliwowe, są to odnawialne i nieodnawialne elektrochemiczne źródła energii Ogniwa pierwotne (inaczej baterie) – rodzaj ogniw galwanicznych w których można otrzymać energię elektryczną w nieodwracalnych procesach elektrochemicznych, oznacza to że po rozładowaniu niemożliwe jest ich powtórne ładowanie. Ogniwa wtórne (inaczej akumulatory) -rodzaj ogniw galwanicznych w których procesach elektrochemicznych, oznacza to że możliwe jest ich wielokrotne ładowanie i rozładowywanie. Ogniwa paliwowe – urządzenie w których w sposób kontrolowany można przeprowadzać spalanie elektrochemiczne takich paliw jak węgiel, węglowodory, wodór i inne 18

Baterie, akumulatory i ogniwa paliwowe Wymagania stawiane elektrochemicznym źródłom energii 1. Możliwie wysoka wartość różnicy potencjałów standardowych układu katody i anody, dająca w sumie wysoką wartość SEM. 2. Wymaga się możliwie najmniejszego odchylenia różnicy potencjałów na zaciskach ogniwa od SEM w czasie pracy źródła prądu. 3. Wymaga się tzw. dużej pojemności prądowej, tj. w efekcie dużej ilości elektryczności możliwej do otrzymania z jednostki masy (lub objętości) elektrolitu. 4. Wymaga się maksymalnej mocy właściwej, tj. maksymalnej ilości energii oddawanej w jednostce czasu przez jednostkę masy (lub objętości) źródła prądu. 5. Wymaga się możliwie małego tzw. samorozładowania, tj. strat energii przy otwartym ogniwie. 6. Wymaga się możliwie niskiego kosztu jednostki mocy uzyskiwanej z jednostkowej masy lub objętości danego ogniwa. 19

Ogniwo Leclanche’go (U=1. 5 V) Ogniwo składa się z pojemnika wykonanego z blachy cynkowej, w którym znajduje się pasta (z dodatkiem krochmalu i trocin) wykonana z chlorku cynku Zn. Cl 2, dwutlenku manganu (Mn. O 2) i chlorku amonowego (NH 4 Cl). Czasem stosuje się niewielkie ilości Cu. Cl 2 i Hg. Cl 2. W paście tej tkwi pręt grafitowy stanowiący katodę. Zn | NH 4 Cl 2, , Zn. Cl 2 | Mn. O 2 | C Zn(s) → Zn 2+(aq) + 2 e 2 Mn. O 2(s) + 2 H+(aq) + 2 e- → Mn 2 O 3(s) + H 2 O(l) NH 4+(aq) → H+(aq) + NH 3(aq) Zn(s) + 2 Mn. O 2(s) + 2 NH 4+(aq) → Mn 2 O 3(s) + Zn(NH 3)22+(aq) + H 2 O(l) 20

Ogniwo alkaliczne (1. 5 V) Zn | Zn. O, KOH | Mn. O 2|C Zn (s) + 2 OH− (aq) → Zn(OH)2 (s) + 2 e− Mn. O 2 (s) + 2 H 2 O (l) + 2 e− →Mn(OH)2 (s) + 2 OH− (aq) Mn. O 2 (s) + Zn(s) + 2 H 2 O (l) →Mn(OH)2 (s) + Zn(OH)2 (s) 21

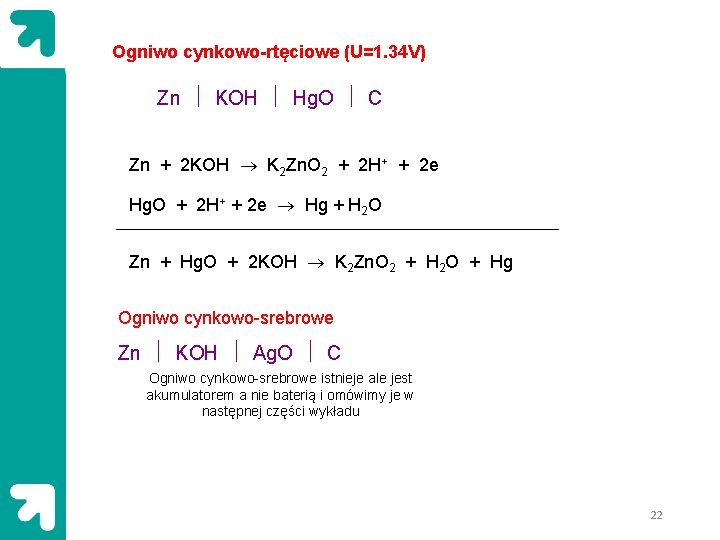
Ogniwo cynkowo-rtęciowe (U=1. 34 V) Zn KOH Hg. O C Zn + 2 KOH K 2 Zn. O 2 + 2 H+ + 2 e Hg. O + 2 H+ + 2 e Hg + H 2 O Zn + Hg. O + 2 KOH K 2 Zn. O 2 + H 2 O + Hg Ogniwo cynkowo-srebrowe Zn KOH Ag. O C Ogniwo cynkowo-srebrowe istnieje ale jest akumulatorem a nie baterią i omówimy je w następnej części wykładu 22

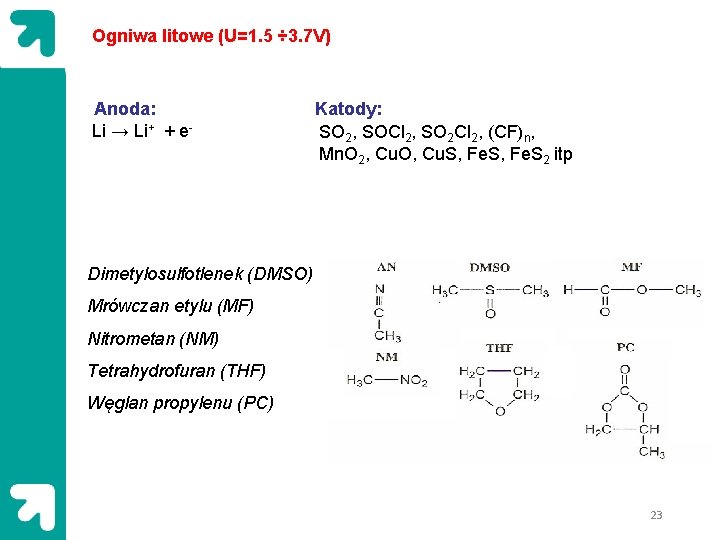
Ogniwa litowe (U=1. 5 ÷ 3. 7 V) Anoda: Li → Li+ + e- Katody: SO 2, SOCl 2, SO 2 Cl 2, (CF)n, Mn. O 2, Cu. O, Cu. S, Fe. S 2 itp Dimetylosulfotlenek (DMSO) Mrówczan etylu (MF) Nitrometan (NM) Tetrahydrofuran (THF) Węglan propylenu (PC) 23

Ogniwa litowe - przykłady Li │ Li+ │ Cu. O 2 Li + Cu. O → Li 2 O + Cu Li │ Li+ │ Cu. S 2 Cu. S + 2 Li → Cu 2 S + Li 2 S (I etap) Cu 2 S + 2 Li → 2 Cu + Li 2 S (II etap) Li │ Li. Al. Cl 4, SOCl 2 │ C 4 Li + 2 SOCl 2 → 4 Li. Cl + SO 2 + S Li | Li. Br, SO 2, AN | C 2 Li + 2 SO 2 → Li 2 S 2 O 4 24

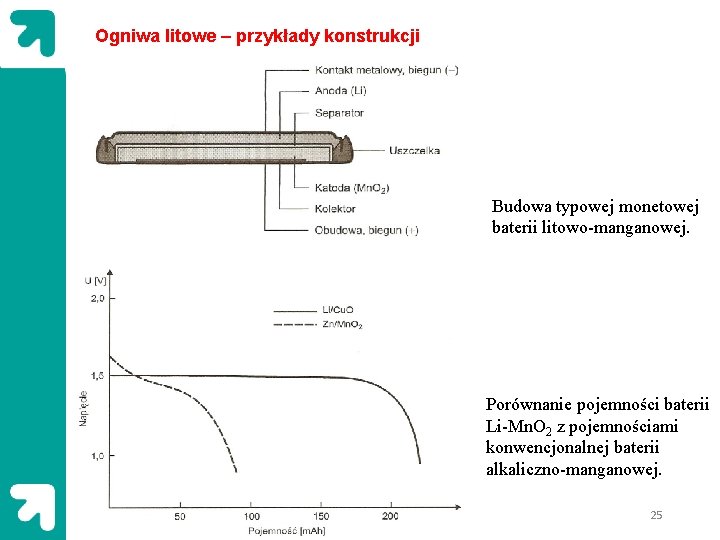
Ogniwa litowe – przykłady konstrukcji Budowa typowej monetowej baterii litowo-manganowej. Porównanie pojemności baterii Li-Mn. O 2 z pojemnościami konwencjonalnej baterii alkaliczno-manganowej. 25

Akumulator ołowiowy (U=2, 2 V) Pb H 2 SO 4 Pb. O 2 Pb Pb (stały) + HSO 4 - + H 2 O ⇄ Pb. SO 4 (stały) + 2 e + H 3 O+ Pb. O 2 (stały) + HSO 4 - + 3 H 3 O+ + 2 e ⇄ Pb. SO 4 (stały) + 5 H 2 O Pb + Pb. O 2 + 2 H 2 SO 4 ⇄ 2 Pb. SO 4 + 2 H 2 O 26

Ogniwo Edisona (NIFE), czyli alkaliczny akumulator niklowo-żelazowy )(U=1, 4 V). Fe KOH Ni. OOH Ni Fe + 2 H 2 O ⇄ Fe(OH)2 + 2 e + 2 H+ Ni. OOH + H+ +e ⇄ Ni(OH)2 Fe + 2 Ni. OOH + 2 H 2 O ⇄ 2 Ni(OH)2 + Fe(OH)2 Akumulator kadmowo-niklowy (U=1, 35 1, 40 V) Cd KOH Ni. OOH Ni Cd + 2 H 2 O ⇄ Cd(OH)2 + 2 e + 2 H+ Ni. OOH + H+ +e ⇄ Ni(OH)2 Cd + 2 Ni. OOH + 2 H 2 O ⇄ 2 Ni(OH)2 + Cd(OH)2 27

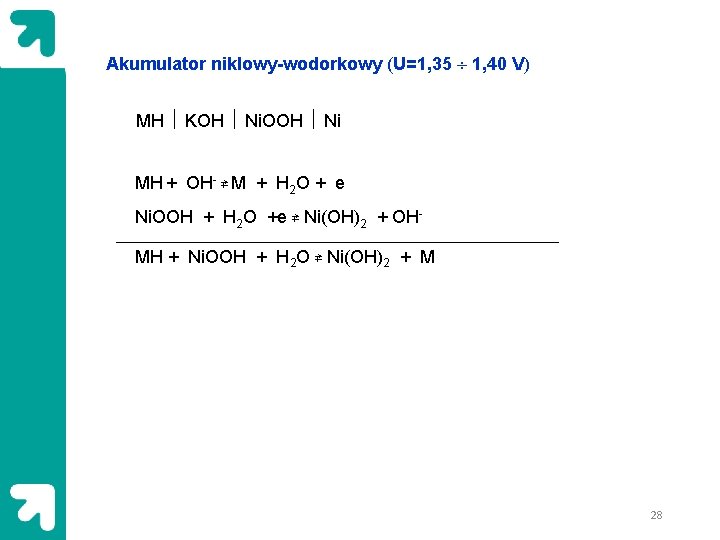
Akumulator niklowy-wodorkowy (U=1, 35 1, 40 V) MH KOH Ni. OOH Ni MH + OH- ⇄ M + H 2 O + e Ni. OOH + H 2 O +e ⇄ Ni(OH)2 + OHMH + Ni. OOH + H 2 O ⇄ Ni(OH)2 + M 28

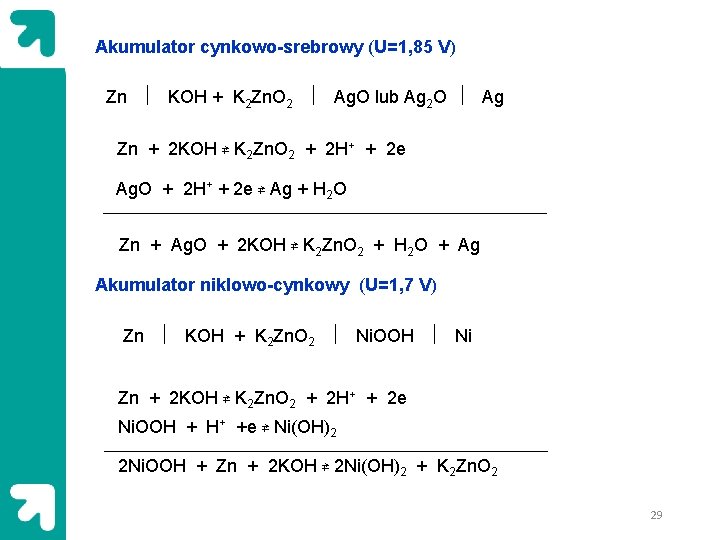
Akumulator cynkowo-srebrowy (U=1, 85 V) Zn KOH + K 2 Zn. O 2 Ag. O lub Ag 2 O Ag Zn + 2 KOH ⇄ K 2 Zn. O 2 + 2 H+ + 2 e Ag. O + 2 H+ + 2 e ⇄ Ag + H 2 O Zn + Ag. O + 2 KOH ⇄ K 2 Zn. O 2 + H 2 O + Ag Akumulator niklowo-cynkowy (U=1, 7 V) Zn KOH + K 2 Zn. O 2 Ni. OOH Ni Zn + 2 KOH ⇄ K 2 Zn. O 2 + 2 H+ + 2 e Ni. OOH + H+ +e ⇄ Ni(OH)2 2 Ni. OOH + Zn + 2 KOH ⇄ 2 Ni(OH)2 + K 2 Zn. O 2 29

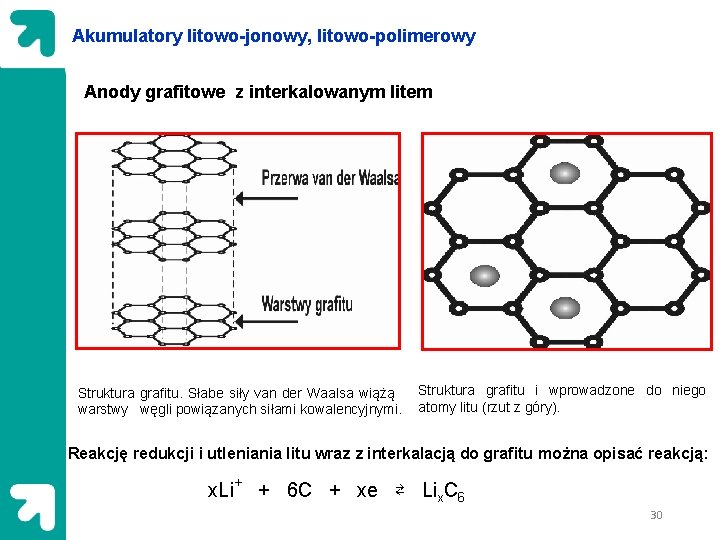
Akumulatory litowo-jonowy, litowo-polimerowy Anody grafitowe z interkalowanym litem Struktura grafitu. Słabe siły van der Waalsa wiążą warstwy węgli powiązanych siłami kowalencyjnymi. Struktura grafitu i wprowadzone do niego atomy litu (rzut z góry). Reakcję redukcji i utleniania litu wraz z interkalacją do grafitu można opisać reakcją: x. Li+ + 6 C + xe ⇄ Lix. C 6 30
![Akumulatory litowojonowy litowopolimerowy Lix GRAFIT MATRYCAkatoda GRAFIT Lix MATRYCAkatoda 31 Akumulatory litowo-jonowy, litowo-polimerowy Lix. GRAFIT + [MATRYCA-katoda] ⇄ [GRAFIT] + Lix. MATRYCA-katoda 31](https://slidetodoc.com/presentation_image_h/a1e7ac47bdd6099004f2849df776dbf1/image-31.jpg)
Akumulatory litowo-jonowy, litowo-polimerowy Lix. GRAFIT + [MATRYCA-katoda] ⇄ [GRAFIT] + Lix. MATRYCA-katoda 31

Akumulatory litowo-jonowy, litowo-polimerowy Lix. C 6 | Li. X elektrolit | Mn 2 O 4 Lix. C 6 ⇄ C 6 + x. Li+ + xe− rozpuszczalnik np węglanu propylenu (PC) + Li. X – Li+ elektrolit akumulator litowo-jonowy politlenek etylenu (PEO) + Li. X + np węglanu propylenu (PC) – akumulator litowo-polimerowy Li 1−x. Mn 2 O 4 + x. Li+ + xe− ⇄ Li. Mn 2 O 4 Li 1−x. Mn 2 O 4 + Lix. C 6 ⇄ Li. Mn 2 O 4 + C 6 32

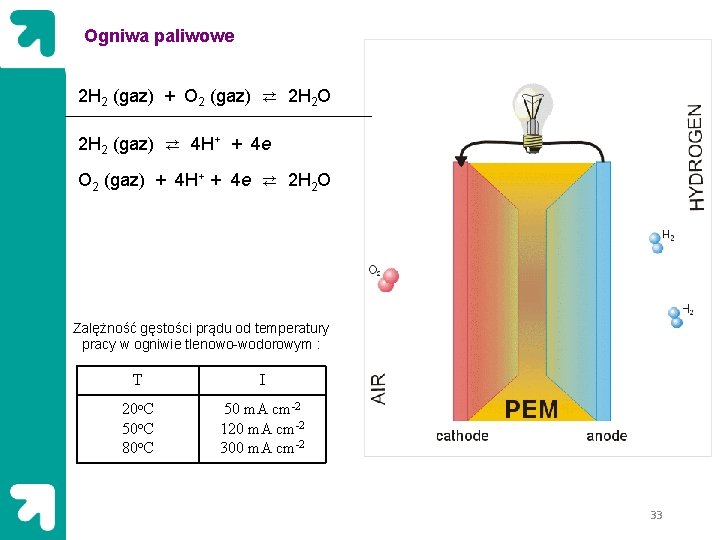
Ogniwa paliwowe 2 H 2 (gaz) + O 2 (gaz) ⇄ 2 H 2 O 2 H 2 (gaz) ⇄ 4 H+ + 4 e O 2 (gaz) + 4 H+ + 4 e ⇄ 2 H 2 O Zalężność gęstości prądu od temperatury pracy w ogniwie tlenowo-wodorowym : T I 20 o. C 50 o. C 80 o. C 50 m. A cm-2 120 m. A cm-2 300 m. A cm-2 33

Ogniwa paliwowe CH 3 OH CO 2 + 6 H+ + 6 e N 2 H 4 + 4 H+ N 2 + 4 H 2 O + 4 e 2 NH 3 + 6 OH- N 2 + 6 H 2 O + 6 e CH 4 + 2 O 2 → CO 2 + 2 H 2 O 34

Literatura 1. H. Scholl, T. Błaszczyk , P. Krzyczmonik, " Elektrochemia. Zarys teorii i praktyki", Wyd. U Ł , 1998 2. I. Koryta, I. Dvorak, V. Bohackowa, "Elektrochemia", PWN , 1980. 3. G. Kortum, "Elektrochemia". 4. W. Libuś, Z. Libuś, "Elektrochemia", PWN , 1987. 5. A. J. Bard, G. Inzelt, F. Scholz, Electrochemical Dictionary Springer, 2008 6. A. Kisza, Elektrochemia I, Jonika, WNT Warszawa, 2000 35

Dziękuje za uwagę































