PODSTAWY CHEMII ANALITYCZNEJ Miareczkowanie strceniowe ANALIZA MIARECZKOWA TITRANT



![MIARECZKOWANIE STRĄCENIOWE M+ + A - titrant analit MA Ks= [M]·[A] 12 (1 : MIARECZKOWANIE STRĄCENIOWE M+ + A - titrant analit MA Ks= [M]·[A] 12 (1 :](https://slidetodoc.com/presentation_image_h2/9924a8fe3222630e7bf8fc126b394d07/image-5.jpg)
![MIARECZKOWANIE STRĄCENIOWE Efekt stężenia M+ + A - titrant analit 10 MA Ks= [M]·[A] MIARECZKOWANIE STRĄCENIOWE Efekt stężenia M+ + A - titrant analit 10 MA Ks= [M]·[A]](https://slidetodoc.com/presentation_image_h2/9924a8fe3222630e7bf8fc126b394d07/image-6.jpg)







- Slides: 20

PODSTAWY CHEMII ANALITYCZNEJ Miareczkowanie strąceniowe

ANALIZA MIARECZKOWA TITRANT roztwór mianowany substancja reagująca z analitem: - selektywnie - ilościowo (stechiometrycznie) - szybko - z P. K. bliskim P. R. (punktowi równoważnikowemu) - z dużym „skokiem” krzywej miareczkowania - z łatwym do stwierdzenia punktem końcowym P. K. ROZTWÓR ANALITU

MIARECZKOWANIE STRĄCENIOWE Titrant Analit Hg 22+ + 2 Cl- Hg 2 Cl 2 Można zamienić rolami 2+ 2 Zn + S Zn. S titrant analit Pb 2+ + SO 42 - Pb. SO 4 (miareczkowanie metalu) Pb 2+ + C 2 O 42 - Pb. C 2 O 4 … wbrew pozorom RZADKO stosowane trudno o mianowane roztwory trudna detekcja P. K. (wskaźniki adsorpcyjne) Wyjątek: często stosowana ARGENTOMETRIA

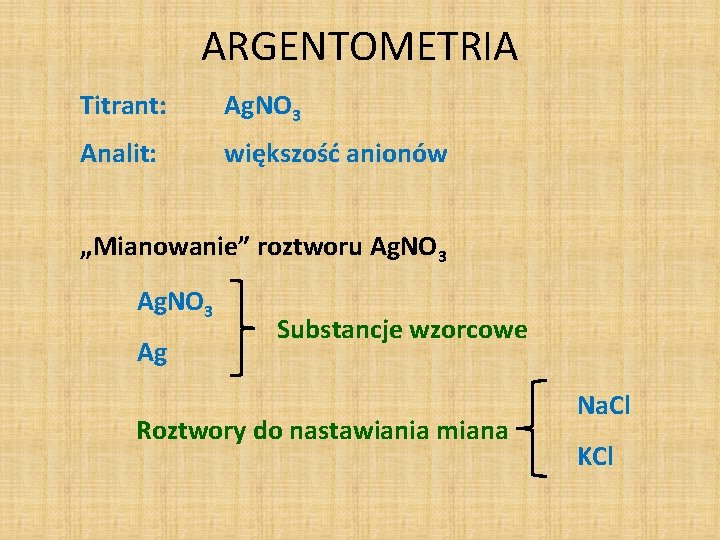
ARGENTOMETRIA Titrant: Ag. NO 3 Analit: większość anionów „Mianowanie” roztworu Ag. NO 3 Ag Substancje wzorcowe Roztwory do nastawiania miana Na. Cl KCl
![MIARECZKOWANIE STRĄCENIOWE M A titrant analit MA Ks MA 12 1 MIARECZKOWANIE STRĄCENIOWE M+ + A - titrant analit MA Ks= [M]·[A] 12 (1 :](https://slidetodoc.com/presentation_image_h2/9924a8fe3222630e7bf8fc126b394d07/image-5.jpg)
MIARECZKOWANIE STRĄCENIOWE M+ + A - titrant analit MA Ks= [M]·[A] 12 (1 : 1) 10 p. A 8 6 c. M= c. A = 1, 0 M p. Ks= 10; KS =10 -10 tylko osad P. R. (100%) 4 2 p. M 0 0% 50% Przybywa osadu Ubywa anionu 100% 150% 200% Przybywa nadmiaru kationu 250%
![MIARECZKOWANIE STRĄCENIOWE Efekt stężenia M A titrant analit 10 MA Ks MA MIARECZKOWANIE STRĄCENIOWE Efekt stężenia M+ + A - titrant analit 10 MA Ks= [M]·[A]](https://slidetodoc.com/presentation_image_h2/9924a8fe3222630e7bf8fc126b394d07/image-6.jpg)
MIARECZKOWANIE STRĄCENIOWE Efekt stężenia M+ + A - titrant analit 10 MA Ks= [M]·[A] 12 8 (1 : 1) p. Ks= 10; KS =10 -10 6 P. R. (100%) 4 2 c. M = c. A = 1, 0 M c. M = c. A = 0, 1 M 0 0% 50% 100% 150% 200% 250%

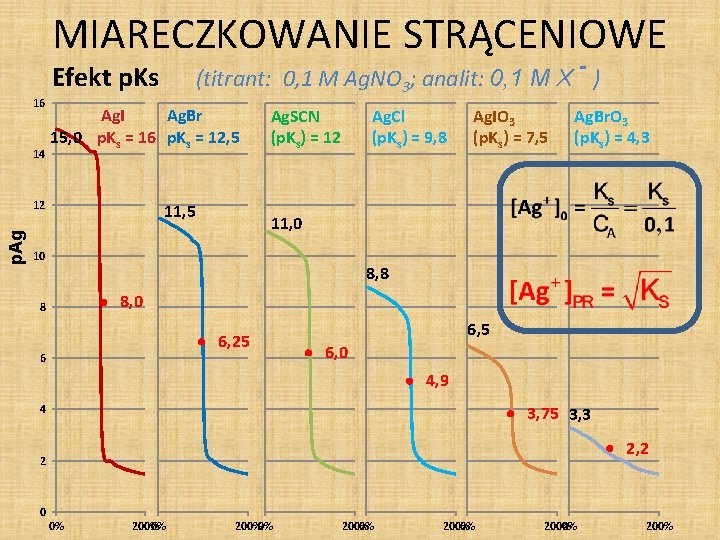
MIARECZKOWANIE STRĄCENIOWE (titrant: 0, 1 M Ag. NO 3; analit: 0, 1 M X - ) Efekt p. Ks 16 14 Ag. I Ag. Br 15, 0 p. Ks = 16 p. Ks = 12, 5 p. Ag 12 11, 5 Ag. SCN (p. Ks) = 12 Ag. Cl (p. Ks) = 9, 8 Ag. IO 3 (p. Ks) = 7, 5 Ag. Br. O 3 (p. Ks) = 4, 3 11, 0 10 8, 8 8, 0 8 6, 25 6 6, 5 6, 0 4, 9 3, 75 3, 3 4 2, 2 2 0 0% 200%0% 200%

MIARECZKOWANIE STRĄCENIOWE WNIOSEK: aby uzyskać jak największy skok krzywej: - Duże stężenie analitu i titrantu - Osad trudnorozpuszczalny (małe KS; duże p. Ks )

ARGENTOMETRIA Titrant: Ag. NO 3; c = 0, 1 M Anality: mieszanina I- + Br- + Cl- 16 p. Ag 15, 0 14 12 p. Ks = 16 p. Ks = 12, 5 p. Ks = 9, 8 11, 5 10 8 Ag. I Ag. Br Ag. Cl I- 8, 0 Br- 6 Detekcja PR ? 8, 8 6, 25 Cl- 4 4, 9 2 0 P. R. (I -) P. R. (Br -) P. R. (Cl -)

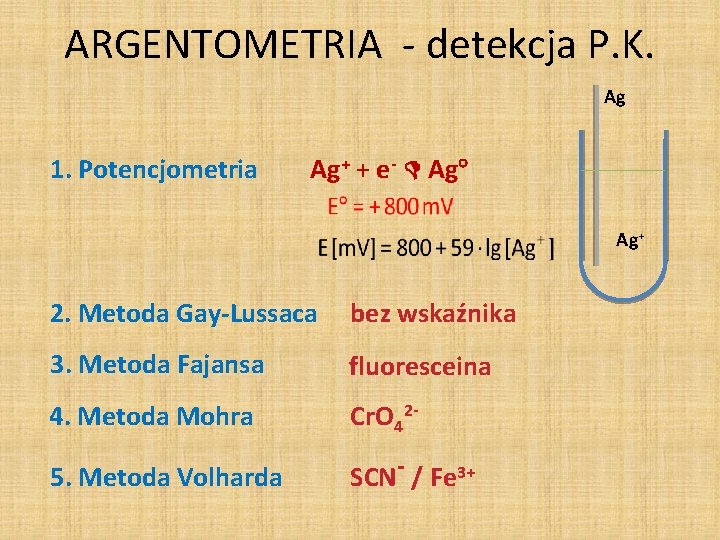
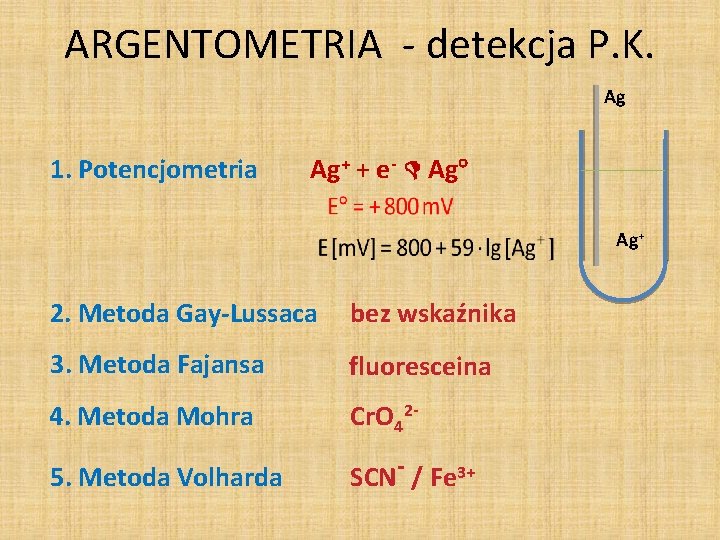
ARGENTOMETRIA - detekcja P. K. Ag 1. Potencjometria Ag+ + e- Ag Ag+ 2. Metoda Gay-Lussaca bez wskaźnika 3. Metoda Fajansa fluoresceina 4. Metoda Mohra Cr. O 42 - 5. Metoda Volharda SCN- / Fe 3+

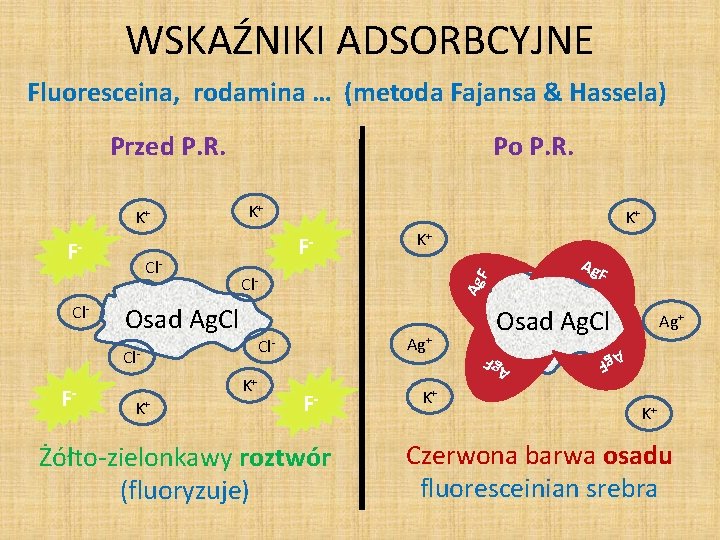
WSKAŹNIKI ADSORBCYJNE Fluoresceina, rodamina … (metoda Fajansa & Hassela) Przed P. R. F- Osad Ag. Cl K+ Ag Ag+ Cl. K+ Ag. F F Cl- F- K+ F- Żółto-zielonkawy roztwór (fluoryzuje) K+ Osad Ag. Cl Ag F Cl- K+ Ag+ F F- K+ Ag K+ Po P. R. K+ Czerwona barwa osadu fluoresceinian srebra

MIARECZKOWANIE STRĄCENIOWE (titrant: 0, 1 M Ag. NO 3; analit: 0, 1 M X - ) Efekt p. Ks 16 14 Ag. I Ag. Br 15, 0 p. Ks = 16 p. Ks = 12, 5 p. Ag 12 11, 5 Ag. SCN (p. Ks) = 12 Ag. Cl (p. Ks) = 9, 8 Ag. IO 3 (p. Ks) = 7, 5 Ag. Br. O 3 (p. Ks) = 4, 3 11, 0 10 8, 8 8, 0 8 6, 25 6 6, 5 6, 0 4, 9 3, 75 3, 3 4 2, 2 2 0 0% 200%0% 200%

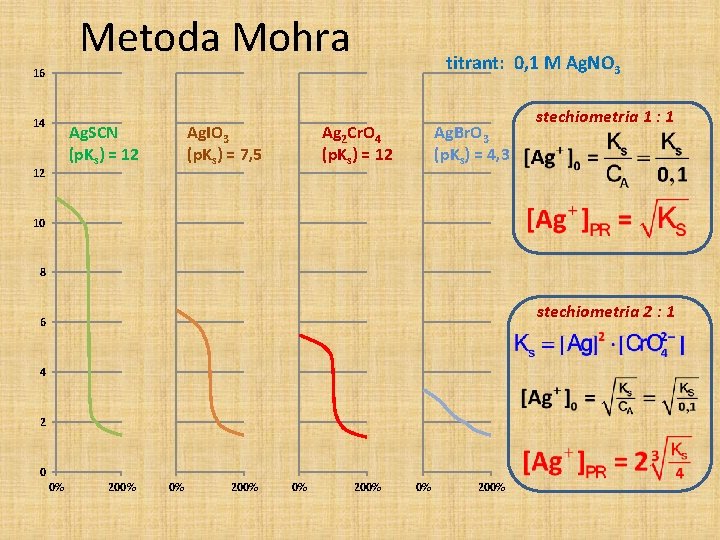
Metoda Mohra titrant: 0, 1 M Ag. NO 3 16 14 Ag. SCN (p. Ks) = 12 12 Ag. IO 3 (p. Ks) = 7, 5 Ag 2 Cr. O 4 (p. Ks) = 12 Ag. Br. O 3 (p. Ks) = 4, 3 stechiometria 1 : 1 10 8 stechiometria 2 : 1 6 4 2 0 0% 200%

Metoda Mohra DETEKCJA PK (nadmiaru jonów srebra): 2 Ag+ + Cr. O 42 - Ag 2 Cr. O 4 Czerwono-brunatny osad Żółty roztwór - Kontrolowane p. H 6, 5 do 10, 5 2 Cr. O 42 - + 2 H+ Cr 2 O 72 - + H 2 O nie działa wskaźnik Ag+ + OH- Ag. OH reakcje uboczne - Przeszkadzają Ba 2+; Sr 2+; Pb 2+ strącają Cr. O 42 - Przeszkadzają CO 32 -; PO 43 - strącanie/współstrącanie - Pozornie można oznaczać „trudniej rozpuszczalne” praktycznie tylko Cl- i Br. Ag. I i Ag. SCN adsorbują Cr. O 42 -

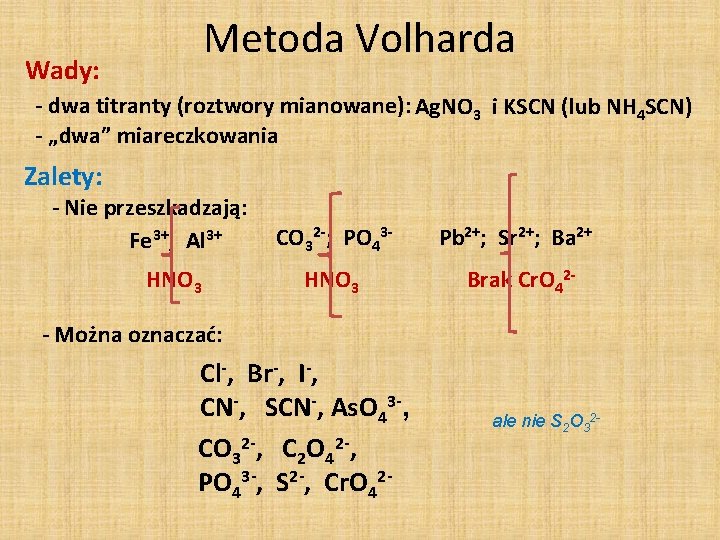
Metoda Volharda - dodać znany nadmiar mianowanego roztworu Ag. NO 3 - odmiareczkować nadmiar Ag. NO 3 mianowanym roztworem rodanków (KSCN lub NH 4 SCN) w obecności Fe 3+ (HNO 3) Analit: X- + Ag+ Ag. X Nadmiar: Ag+ + SCN- Ag. SCN Detekcja P. K. : SCN- + Fe 3+ Fe. SCN 2+ Czerwona barwa roztworu - pierwsze „miareczkowanie” - próbka MOŻE być zakwaszona (w zależności od natury analitu) - drugie miareczkowanie - próbka MUSI być zakwaszona (Fe 3+) - czy oddzielać osad między miareczkowaniami? (w zależności od natury analitu)

Metoda Volharda Wady: - dwa titranty (roztwory mianowane): Ag. NO 3 i KSCN (lub NH 4 SCN) - „dwa” miareczkowania Zalety: - Nie przeszkadzają: Fe 3+; Al 3+ HNO 3 CO 32 -; PO 43 - Pb 2+; Sr 2+; Ba 2+ HNO 3 Brak Cr. O 42 - - Można oznaczać: Cl-, Br-, I-, CN-, SCN-, As. O 43 -, CO 32 -, C 2 O 42 -, PO 43 -, S 2 -, Cr. O 42 - ale nie S 2 O 32 -

Metoda Volharda oddzielać osad czy nie (przed II miareczkowaniem)? nie: np. Cl-, Br-, I-, SCN-, As. O 43 tak: np. Cl-, CN- , CO 32 -, C 2 O 42 -, PO 43 -, S 2 -, Cr. O 42 - ponieważ rozkładają się w środowisku kwaśnym, - ponieważ reagują z jonami żelaza III, - ponieważ są bardziej rozpuszczalne niż Ag. SCN (np. chlorki) Ag. Cl + SCN- Ag. SCN + Cl- p. Ks=9, 8 (Cl-) CCl 4 CHCl 3 C 6 H 5 NO 2 p. Ks=12. 0 nie miesza się z H 2 O, ale lepiej zwilża osad niż H 2 O (odcina dostęp jonów)

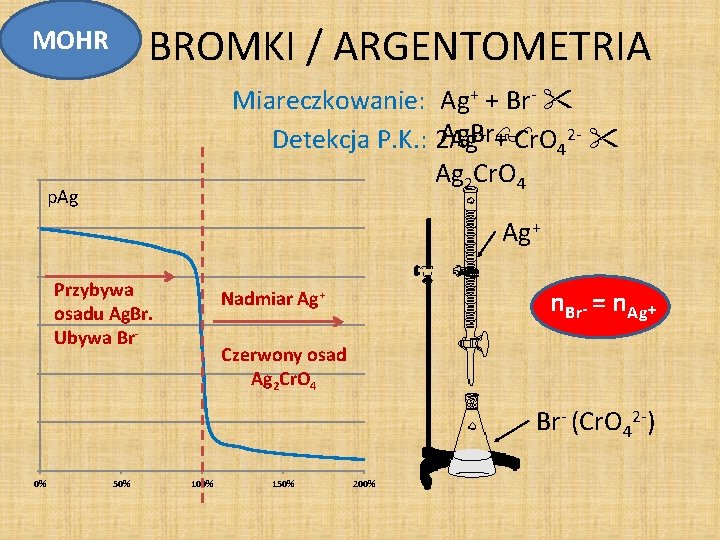
BROMKI / ARGENTOMETRIA MOHR Miareczkowanie: Ag+ + Br- + + Cr. O 2 - Ag. Br Detekcja P. K. : 2 Ag 4 Ag 2 Cr. O 4 p. Ag Ag+ Przybywa osadu Ag. Br. Ubywa Br- n. Br- = n. Ag+ Nadmiar Ag+ Czerwony osad Ag 2 Cr. O 4 Br- (Cr. O 42 -) 0% 50% 100% 150% 200%

BROMKI / ARGENTOMETRIA VOLHARD p. Ag p. SCN- Ag+ Fe 3+ Przybywa osadu Ag. Br P. R. 1 Br- Nadmiar Ag+ 0% 50% 100% 150% 200% VAg. NO 3 Przybywa Ag+ Ag. Br osadu Ag. SCN P. R. 2 Nadmiar SCNCzerwony Fe. SCN 2+ 0% „Miareczkowanie” 1: Ag+ + „titrant” Nie ma 100% 150% 200% VKSCN Miareczkowanie 2: Ag+ + SCN- Ag. SCN Br- Ag. Br analit (+ nadmiar Ag+) Detekcja PK. 1: 50% „analit” Detekcja PK. 2: n. Br- = n. Ag+ - n. SCN- titrant Fe 3+ + SCN- Fe. SCN 2+

ARGENTOMETRIA - detekcja P. K. Ag 1. Potencjometria Ag+ + e- Ag Ag+ 2. Metoda Gay-Lussaca bez wskaźnika 3. Metoda Fajansa fluoresceina 4. Metoda Mohra Cr. O 42 - 5. Metoda Volharda SCN- / Fe 3+
 Carbohydrates
Carbohydrates Wkład polaków w rozwój chemii
Wkład polaków w rozwój chemii Kolory w chemii nieorganicznej
Kolory w chemii nieorganicznej Jądrowe
Jądrowe Substancje wzorcowe w alkacymetrii
Substancje wzorcowe w alkacymetrii Reakcje protolityczne
Reakcje protolityczne Wyznaczanie stałej naczynka konduktometrycznego
Wyznaczanie stałej naczynka konduktometrycznego Alkacymetria zadania
Alkacymetria zadania Argentometria
Argentometria Miareczkowanie podstawieniowe
Miareczkowanie podstawieniowe Miareczkowanie odwrotne
Miareczkowanie odwrotne Napięcie powierzchniowe wody wartość
Napięcie powierzchniowe wody wartość Monitorowanie podstawy programowej
Monitorowanie podstawy programowej Realizacja podstawy programowej w edukacji wczesnoszkolnej
Realizacja podstawy programowej w edukacji wczesnoszkolnej Business process modeling notation examples
Business process modeling notation examples Osnowa dokumentu
Osnowa dokumentu Implementacja bazy danych
Implementacja bazy danych Podstawy tworzenia stron internetowych
Podstawy tworzenia stron internetowych Spalanie bezpłomieniowe żarzenie
Spalanie bezpłomieniowe żarzenie Czcionka
Czcionka Reforma podstawy programowej
Reforma podstawy programowej





































