INTEGRANTES v Cruz Mndez Ana Cintia v Galicia









































- Slides: 52

INTEGRANTES: v. Cruz Méndez Ana Cintia v. Galicia v. Huesca Narciso Cristina Balderas Alejandra v. Juárez Ortíz Laura Ivonne v. Melgarejo Rubio Guadalupe EQUIPO NEÓN

v. Bloque d v. Metales G de transición. S O P RU , 5 , 4 , 3 . 7 6 Y

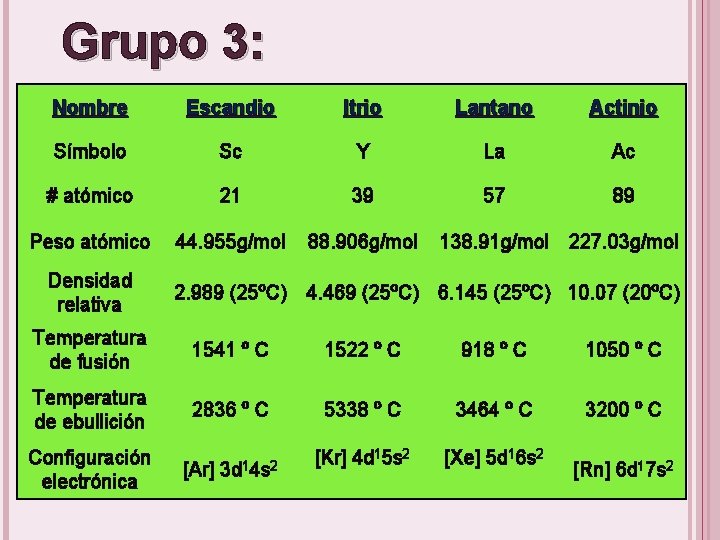
Grupo 3: Nombre Escandio Itrio Lantano Actinio Símbolo Sc Y La Ac # atómico 21 39 57 89 Peso atómico 44. 955 g/mol 88. 906 g/mol Densidad relativa 138. 91 g/mol 227. 03 g/mol 2. 989 (25ºC) 4. 469 (25ºC) 6. 145 (25ºC) 10. 07 (20ºC) Temperatura de fusión 1541 º C 1522 º C 918 º C 1050 º C Temperatura de ebullición 2836 º C 5338 º C 3464 º C 3200 º C Configuración electrónica [Ar] 3 d 14 s 2 [Kr] 4 d 15 s 2 [Xe] 5 d 16 s 2 [Rn] 6 d 17 s 2

CARACTERÍSTICAS: DIO N A SC E §Resistente a la corrosión. §Tiene isótopos con peso atómico entre 40 -51. ITR IO §Dúctil. §Alta reactividad. §Tiene isótopos con peso atómico entre 80 -99. LAN TAN O §Maleable. §Dúctil. §Tiene isótopos con peso atómico entre 125 -149. IO N I T C A §Brilla en la oscuridad. §Muy radioactivo §Tiene isótopos con peso atómico entre 210 -232.

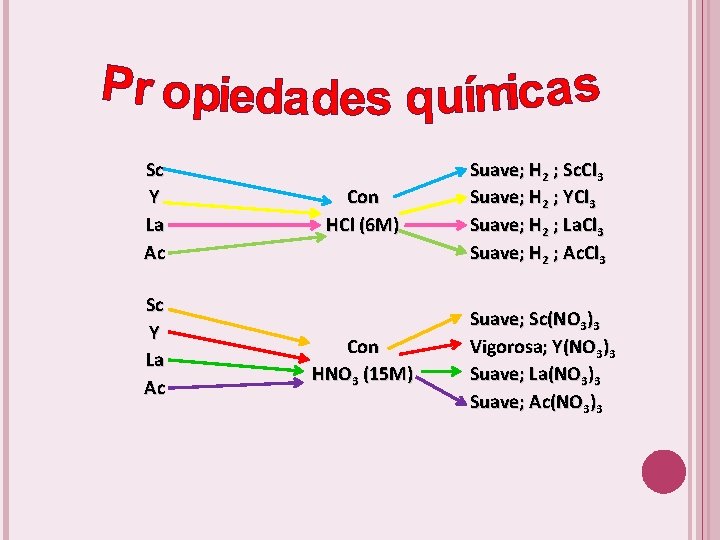
Sc Y La Ac Con aire Con H 2 O Vigorosa; Sc 2 O 3 Vigorosa: Y 2 O 3 (blanco, pesado) Vigorosa; con calor La 2 O 3 Suave; con calor Ac 2 O 3 Suave; H 2 ; Sc(OH)3 Suave; H 2 ; Y(OH)3 Suave; H 2 ; La(OH)3 Suave; H 2 ; Ac(OH)3

Sc Y La Ac Con HCl (6 M) Suave; H 2 ; Sc. Cl 3 Suave; H 2 ; YCl 3 Suave; H 2 ; La. Cl 3 Suave; H 2 ; Ac. Cl 3 Con HNO 3 (15 M) Suave; Sc(NO 3)3 Vigorosa; Y(NO 3)3 Suave; La(NO 3)3 Suave; Ac(NO 3)3

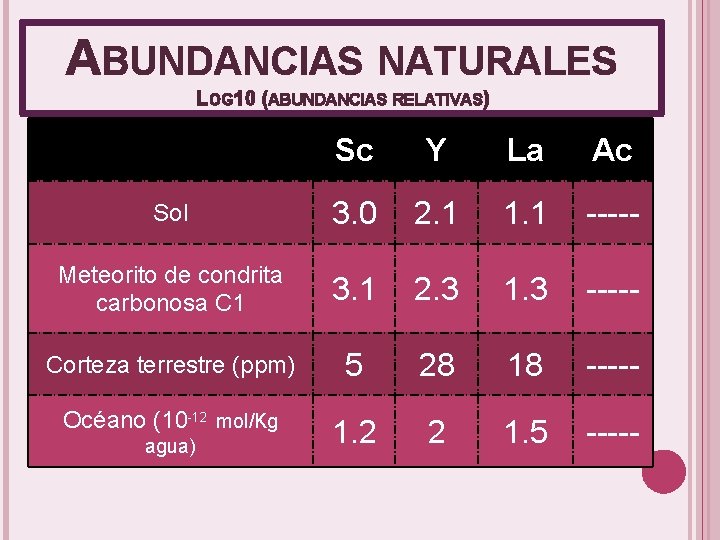
ABUNDANCIAS NATURALES LOG 10 (ABUNDANCIAS RELATIVAS) Sc Y La Ac Sol 3. 0 2. 1 1. 1 ----- Meteorito de condrita carbonosa C 1 3. 1 2. 3 1. 3 ----- Corteza terrestre (ppm) 5 28 18 ----- Océano (10 -12 mol/Kg 1. 2 2 1. 5 ----- agua)

MÉTODOS DE OBTENCIÓN. * Sc, Y, La: Desplazamiento de intercambio iónico. R= Sc 3+ + 3 Cl - Sc. Cl 3 Ø Electrólisis de una mezcla eutéctica. Ø Reducción de halogenuro con calcio metal (o litio). 3 Ca + 2 YF 3 ---- 2 Y + 3 Ca. F 2 Ø Arena monocita (fosfatos de calcio, torio, cerio y otras tierras raras) 50% Tierras raras 25% Lantano 3% Itrio Las impurezas se pueden quitar magnéticamente o por procesos de flotación. Ø

MÉTODOS DE OBTENCIÓN. *Ac : Ø Pechblenda (1 tonelada – 0. 1 g Ac) Ø Reducción de fluoruro de actinio con vapor caliente de litio (1100 y 1300 ºC). Ac. F 3 + 3 Li ----- Ac + 3 Li. F Ø Suele obtenerse artificialmente bombardeando 226 Ra con neutrones

e ad d i ns e t in v. Con a t l st a lá mp v O 3 2 c S s d a rucció n de n aves espac iales v. Isótopo radiactiv o Sc-46 craqueo s del petr óleo com e usa en el o trazad or. v. Lámparas de vapor de mercurio

v. Granate de itrio es una piedra preciosa. v. Incrementar la resistencia de las aleaciones de Al y Mg. v. Filtros de los microondas. v. Componente rojo de los receptores de televisión a color

v. Lámparas de arco de carbono. v. El lantano impuro se utiliza para fabricar piedras para encendedores v. Aleaciones v. Lentes de cámaras.

v. El 225 Ac se emplea en medicina en la producción de Bi-213 utilizado en radioterapia. v. Casi exclusivo para investigaciones científicas v. Emisor de partículas radiactivas.

Zr Ti Hf Rf

Titanio: 22 Ti Nombre Número atómico Valencia Titanio 22 2, 3, 4 Estado de oxidación +4 Electronegatividad 1, 5 Radio covalente (Å) 1, 36 Radio iónico (Å) 0, 68 Radio atómico (Å) 1, 47 Configuración electrónica Primer potencial de ionización (e. V) Masa atómica (g/mol) [Ar]3 d 24 s 2 6, 89 47, 90 Densidad (g/ml) 4, 51 Punto de ebullición (ºC) 3260 Punto de fusión (ºC) 1668 Descubridor William Gregor en 1791

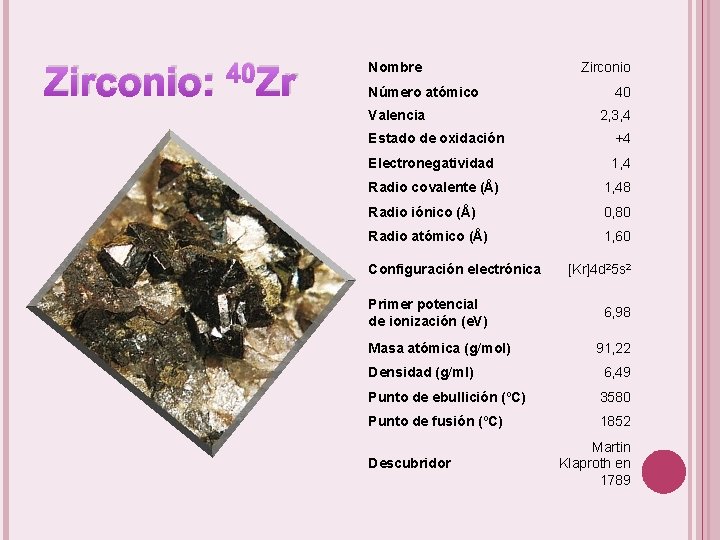
Zirconio: 40 Zr Nombre Número atómico Valencia Zirconio 40 2, 3, 4 Estado de oxidación +4 Electronegatividad 1, 4 Radio covalente (Å) 1, 48 Radio iónico (Å) 0, 80 Radio atómico (Å) 1, 60 Configuración electrónica Primer potencial de ionización (e. V) Masa atómica (g/mol) [Kr]4 d 25 s 2 6, 98 91, 22 Densidad (g/ml) 6, 49 Punto de ebullición (ºC) 3580 Punto de fusión (ºC) 1852 Descubridor Martin Klaproth en 1789

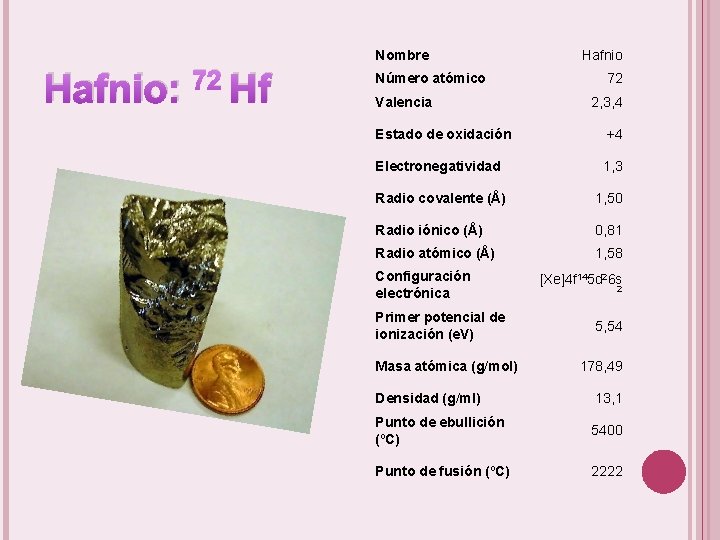
Nombre Hafnio: 72 Hf Número atómico Valencia Hafnio 72 2, 3, 4 Estado de oxidación +4 Electronegatividad 1, 3 Radio covalente (Å) 1, 50 Radio iónico (Å) 0, 81 Radio atómico (Å) 1, 58 Configuración electrónica Primer potencial de ionización (e. V) Masa atómica (g/mol) [Xe]4 f 145 d 26 s 2 5, 54 178, 49 Densidad (g/ml) 13, 1 Punto de ebullición (ºC) 5400 Punto de fusión (ºC) 2222

Rutherfordio: 104 Rf Nombre Número atómico Rutherfordio 104 Valencia - Estado de oxidación - Electronegatividad - Radio covalente (Å) - Radio iónico (Å) - Radio atómico (Å) - Configuración electrónica Primer potencial de ionización (e. V) Masa atómica (g/mol) [Rn]5 f 146 d 27 s 2 261 Densidad (g/ml) - Punto de ebullición (ºC) - Punto de fusión (ºC) - Descubridor Desconocid o

Abundancia en el Planeta El 9° elemento de los que forman la corteza terrestre (5, 600 ppm). El titanio no se encuentra libre en la naturaleza, los minerales que muestran una mayor concentración de este metal son el rutilio (Ti. O 2) y la ilmenita (Fe. O • Ti. O 2), además de la anatasa y la brookita (ambas son también Ti. O 2). El 18° elemento que conforma la corteza terrestre (190 ppm). Los minerales más importantes en los que se encuentra son el circón (Zr. Si. O 4) y la badeleyita (Zr. O 2). El hafnio se extrae junto con el zirconio de sus minerales y se halla con el zirconio en todos sus derivados. (5. 3 ppm) No se encuentra en la naturaleza y se ha sintetizado en tazas mínimas

Sintesis y métodos de obtención: Titanio: Se utiliza el método de Kroll • Obtención de tetracloruro de titanio por cloración a 900 °C, en presencia de carbono, mediante la reacción: 2 Fe. Ti. O 3 + 7 Cl 2 + 6 C → 2 Ti. Cl 4 + 2 Fe. Cl 3 + 6 CO • Purificación del tetracloruro de titanio: Ti. Cl 4 + 4 Na → 4 Na. Cl + Ti • Si se utiliza el Magnesio (Mg) para purificarlo se produce la siguiente reacción: Ti. Cl 4 + 2 Mg → Ti + 2 Mg. Cl 2 Zirconio: El metal se obtiene principalmente mediante una cloración reductiva a través del denominado proceso de Kroll: primero se prepara el cloruro, para después reducirlo con magnesio. la obtención del metal con mayor pureza se sigue el proceso Van Arkel basado en la disociación del yoduro de circonio Hafnio: Aproximadamente la mitad de todo el hafnio metálico producido se obtiene como subproducto de la purificación del circonio. Esto se hace reduciendo el tetracloruro de hafnio (Hf. Cl 4) con magnesio o sodio en el proceso de Kroll. Rutherfordio: Los rusos lo obtuvieron mediante reacciones de colisión entre los isótopos 242 Pu y 22 Ne. Los americanos lo consiguieron por reacción de colisión entre 249 Cf y 12 C.

Aplicaciones Titanio Industria energética Industria automovilística: Industria militar Industria aeronáutica y espacial Construcción naval Industria relojera Joyería Instrumentos deportivos Decoración Zirconio Aditivo en aceros obteniéndose materiales muy resistentes Fabricar crisoles de laboratorio Agente incendiario. Imanes superconductores Joyería Recubrimiento de reactores nucleares.

Hafnio En lámparas de gas e incandescentes. En catalizadores para polimerización metalocénica. Para eliminar oxígeno y nitrógeno de tubos de vacío. En aleaciones de hierro, titanio, niobio, tántalo y otras aleaciones metálicas. Reactores nucleares Revestimiento de barras de control de submarinos

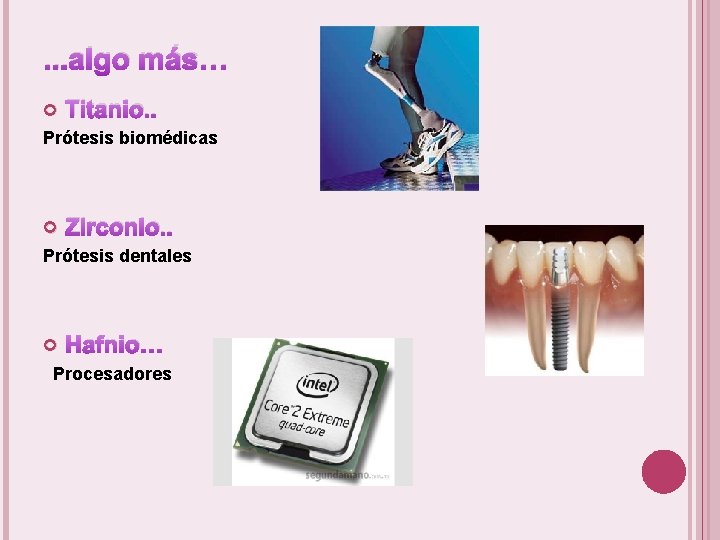
. . . algo más… Titanio. . Prótesis biomédicas Zirconio. . Prótesis dentales Hafnio… Procesadores

GRUPO 5 Vanadio, Niobio, Tántalo y Dubnio

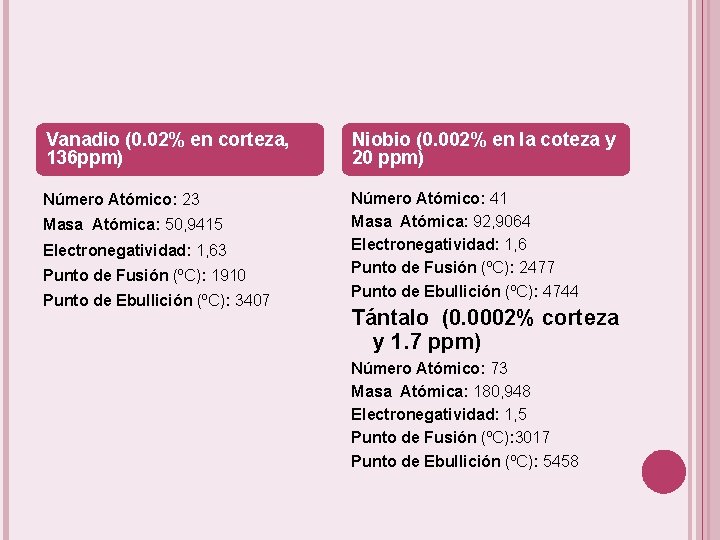
Vanadio (0. 02% en corteza, 136 ppm) Niobio (0. 002% en la coteza y 20 ppm) Número Atómico: 23 Número Atómico: 41 Masa Atómica: 92, 9064 Electronegatividad: 1, 6 Punto de Fusión (ºC): 2477 Punto de Ebullición (ºC): 4744 Masa Atómica: 50, 9415 Electronegatividad: 1, 63 Punto de Fusión (ºC): 1910 Punto de Ebullición (ºC): 3407 Tántalo (0. 0002% corteza y 1. 7 ppm) Número Atómico: 73 Masa Atómica: 180, 948 Electronegatividad: 1, 5 Punto de Fusión (ºC): 3017 Punto de Ebullición (ºC): 5458

MINERALES Vanadio: Vanadita (Pb₅(VO₄)₃Cl), Carnotita (K₂(UO₂)₂(VO₄)₂ • 3 H₂O, Patronita (VS₄) Niobio: niobita ((Fe)(Nb₂O₆)) o Mg Tántalo: tantalita ((Fe)(Ta₂O₆)), itrotantalita (Ta₆Fe₄O₂₁)

OBTENCIÓN Vanadio: V₂O₅ + 5 Ca → 5 Ca. O + 2 V 2 VCl₃ + 3 Mg → 3 Mg. Cl₂ + 2 V Y electrolisis de VCl₂ Proceso van Arkel-de Boer (ioduro del metal) Niobio y Tántalo: Estan minerales están juntos, se disuelven en acido fluorhídrico (HF) formando K 4(Ta 4 O 5 F 14) y Nb₂O₅, el Ta se obtiene por hidrólisis o reducción con Na y el Nb con dos reducción con Na Nb₂O₅ + 5 Na → 5 Na. O + 2 Nb

PROPIEDADES QUÍMICAS Cuando están como polvo, los tres son muy inflamables. Forman una película de oxido que impide que se sigan oxidando Son insolubles en la mayoría de los ácidos, sol se disuelven en acido fluorhídrico, el Nb y el V son resistentes a la corrosión alcalina pero el Ta si es atacado por hidróxidos alcalinos fundidos La conductividad aumenta hacia abajo: Ta >Nb >V El V es gris, blando y dúctil se oxida fácilmente por arriba de los 660⁰ C, es tóxico, el V₂O₅ es anfótero El Nb es gris, blando y dúctil, no tóxico El Ta por encima de los 150⁰ C puede reaccionar con Cl y S es gris, duro, dúctil y maleable, no tóxico

USOS Vanadio: acero inoxidable, recubrimiento en reactores nucleares, imanes superconductores, catalizador, en fabricación de cerámica Niobio: Acero inoxidable, imanes superconductores, sistemas de distribución de aire de cápsulas espaciales Tántalo: fabricar condensadores electrolíticos y partes de hornos de vacío, (revestimiento, vasijas inoxidables), reactores nucleares, aviones, cohetes, inerte a los líquidos corporales y no producir irritación se usa en la fabricación de material quirúrgico, electronicos copactos.

CURIOSIDADES Vanadio: fue descubierto por Manuel del rio en México en 1801, es muy colorido en disolución ( V 5+ incoloro, V 4+ azul , V 3+ verde V 2+ violeta) y el nombre viene de Vanadis diosa escandinava de la belleza Niobio: llamado así en honor de Niobe, hija de Tántalo fue descubierto por Charles Hatchett 1801, también se le conoce como Columbio. Tántalo: Descubierto en 1802 por Ekeberg

DUBNIO (DB) O Unnilpentium es un elemento sintético Es muy inestable 8 vida media 1. 6 s Descubierto por Científicos de Dubna

ELEMENTOS DEL GRUPO 6

ELEMENTOS GRUPO 6 Cromo Molibdeno Wolframio Seaborgio

CARACTERÍSTICAS GENERALES Poseen 6 electrones de valencia (2 electrones en la última capa y 4 en la penúltima). El máximo estado de oxidación es +6, aunque la estabilidad de estado crece con el número atómico. Son estables frente a las bases y los ácidos débilmente oxidantes. Con los hidróxidos alcalinos fundidos dan lugar a cromatos, molibdatos y wolframatos. Tienen gran importancia sus aleaciones con el hierro para la fabricación de herramientas. La mayoría de las combinaciones de los elementos son coloreadas, por lo que encuentran aplicación como pigmentos. Los carburos son muy duros y se emplean como abrasivos y los sulfuros tienen una estructura en capas que los hace útiles como lubricantes térmicamente estables.

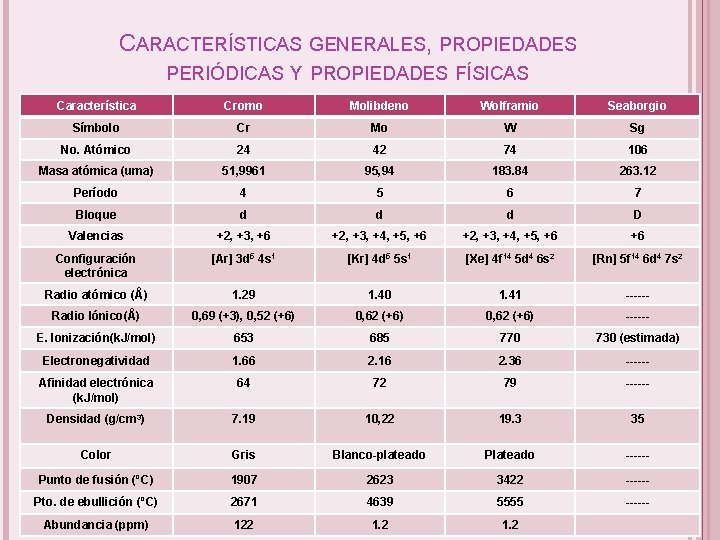
CARACTERÍSTICAS GENERALES, PROPIEDADES PERIÓDICAS Y PROPIEDADES FÍSICAS Característica Cromo Molibdeno Wolframio Seaborgio Símbolo Cr Mo W Sg No. Atómico 24 42 74 106 Masa atómica (uma) 51, 9961 95, 94 183. 84 263. 12 Período 4 5 6 7 Bloque d d d D Valencias +2, +3, +6 +2, +3, +4, +5, +6 +6 Configuración electrónica [Ar] 3 d 5 4 s 1 [Kr] 4 d 5 5 s 1 [Xe] 4 f 14 5 d 4 6 s 2 [Rn] 5 f 14 6 d 4 7 s 2 Radio atómico (Å) 1. 29 1. 40 1. 41 ------ Radio Iónico(Å) 0, 69 (+3), 0, 52 (+6) 0, 62 (+6) ------ E. Ionización(k. J/mol) 653 685 770 730 (estimada) Electronegatividad 1. 66 2. 16 2. 36 ------ Afinidad electrónica (k. J/mol) 64 72 79 ------ Densidad (g/cm 3) 7. 19 10, 22 19. 3 35 Color Gris Blanco-plateado Plateado ------ Punto de fusión (ºC) 1907 2623 3422 ------ Pto. de ebullición (ºC) 2671 4639 5555 ------ Abundancia (ppm) 122 1. 2

CROMO Descubierto en 1798 en Francia. Se obtiene a través de la electrólisis de sales de cromo (III) o por reducción del trióxido de cromo con aluminio. Cr 2 O 3 + 2 Al 2 Cr + Al 2 O 3 Se utiliza para la obtención de acero inoxidable y ferrocromo. Para el cromado. Color de las esmeraldas y rubíes. La cromita, Fe. Cr 2 O 4, se emplea para la obtención de materiales refractarios. Los cromatos y dicromatos son sustancias iniciales para la preparación de colorantes, inhibidores de la corrosión, fungicidas, esmaltes cerámicos.

MOLIBDENO Se descubrió en 1781 en Suecia. Se obtiene como subproducto de la minería del cobre y wolframio. El metal en polvo se obtiene por reducción en caliente de trióxido de molibdeno con hidrógeno. Mo. O 3 + H 2 → Mo. O 2 + H 2 O Se emplea en aleaciones refractarias con níquel, para resistir altas temperaturas y corrosión; en otras proporciona dureza, o también en imanes permanentes. Se utiliza como catalizador en el refinado del petróleo. Se emplea en la construcción de piezas de misiles y aviones.

WOLFRAMIO Fue descubierto en 1783 en España. El wolframio también puede ser extraído por reducción con hidrógeno de WF 6 + 3 H 2 → W + 6 HF El wolframio y sus aleaciones se emplean en filamentos de lámparas eléctricas, tubos electrónicos y de televisión, y en la técnica de evaporación de metales. Se emplea en bobinas y otros elementos de calefacción de hornos eléctrico. Los wolframatos de calcio y de magnesio se emplean en luces fluorescentes. El trióxido de wolframio se usa en pinturas y cerámica. Tiene el punto de fusión más elevado de todos los metales y el punto de ebullición más alto de todos los elementos conocidos.

SEABORGIO Se obtuvo en 1974 en USA. Los rusos lo obtuvieron bombardeando isótopos de plomo con iones de alta energía de 54 Cr; mientras que, los americanos lo obtuvieron colisionando iones 18 O con iones de 249 Cf. Es un elemento sintético cuyo isótopo más estable es el 271 Sg que tiene una vida media de 2, 4 minutos.

CURIOSIDADES El Origen del nombre del cromo, proviene de la palabra griega "chroma", que significa "color", llamado así por los numerosos compuestos coloreados de cromo que se conocen. Aproximadamente dos terceras partes del molibdeno consumido en el planeta se emplean en aleaciones. El elemento, según los países, recibe el nombre de tungsteno o de wolframio. En países de habla inglesa y francesa se emplea el nombre de tungsteno. El nombre wolframio procede del alemán, de la wolframita, mineral donde se encontró el elemento. El seaborgio fue descubierto casi simultáneamente por dos laboratorios diferentes, uno conformado por estadounidenses y otro por soviéticos.


GRUPO 7 Mn, Tc, Re, Bh

Valencia 25 MN: MANGANESO Estado de oxidación +2 Electronegatividad 1, 5 Radio covalente (Å) 1, 39 Radio iónico (Å) 0, 80 Radio atómico (Å) 1, 26 Configuración electrónica Potencial primero de ionización (e. V) Masa atómica (g/mol) [Ar]3 d 54 s 2 7, 46 54, 938 Densidad (g/ml) 7, 43 Punto de ebullición (ºC) 2150 Punto de fusión (ºC) 1245 Descubridor Johann Gahn en 1774

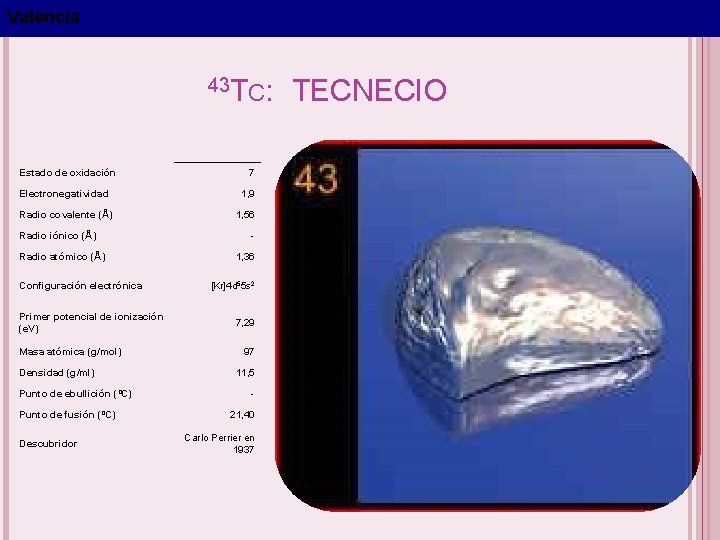
Valencia 43 TC: TECNECIO Estado de oxidación 7 Electronegatividad 1, 9 Radio covalente (Å) 1, 56 Radio iónico (Å) Radio atómico (Å) Configuración electrónica Primer potencial de ionización (e. V) Masa atómica (g/mol) Densidad (g/ml) Punto de ebullición (ºC) Punto de fusión (ºC) Descubridor 1, 36 [Kr]4 d 55 s 2 7, 29 97 11, 5 21, 40 Carlo Perrier en 1937

Valencia 75 RE RENIO Estado de oxidación - Electronegatividad 1, 9 Radio covalente (Å) 1, 59 Radio iónico (Å) Radio atómico (Å) Configuración electrónica Primer potencial de ionización (e. V) Masa atómica (g/mol) 1, 37 [Xe]4 f 145 d 56 s 2 7, 94 186, 2 Densidad (g/ml) 21, 0 Punto de ebullición (ºC) 5900 Punto de fusión (ºC) 3180 Descubridor Walter Noddack en 1925

Nombre 107 BH BOHRIO Estado de oxidación - Electronegatividad - Radio covalente (Å) - Radio iónico (Å) - Radio atómico (Å) - Configuración electrónica [Rn]5 f 146 d 57 s 2 Primer potencial de ionización (e. V) Masa atómica (g/mol) (262) Densidad (g/ml) - Punto de ebullición (ºC) - Punto de fusión (ºC) - Descubridor Peter Armbruster y Gottfried Munzenber en 1976

ABUNDANCIA EN EL PLANETA Mn: no se encuentra en estado libre excepto en los meteoritos. Ocupa el 12º puesto en abundancia en la naturaleza, en la que se presenta como óxido, carbonato y silicato en minerales como la manganita, rodocrosita y pirolusita. Re: Es un elemento muy escaso que se encuentra acompañando al molibdeno en la molibdenita. Es el 79º en orden de abundancia en la corteza terrestre. Tc: En la Tierra, el tecnecio se encuentra en trazas detectables como producto de la fisión espontánea en minerales de uranio por acción de la captura de neutrones en menas de molibdeno. Bh: No se encuentra en la naturaleza y se ha sintetizado en tazas mínimas

SÍNTESIS Y MÉTODOS DE OBTENCIÓN Manganeso: Calentado Mn. O 2, se forma Mn 3 O 4 que se reduce con Aluminio, Carbono, Sodio o Magnesio. También puede purificarse electrolíticamente Tc: La mayoría del tecnecio producido en la Tierra se obtiene como subproducto de la fisión del 235 U en los reactores nucleares y se extrae de las varillas de combustible nuclear. Reducción de Tc 2 S 7 con H 2 a alta temperatura Renio: Re recupera en los polvos que se generan en los tostadores de los minerales de sulfuro de molibdeno. En la tostación de sulfuro se produce la oxidación del renio que se reduce con H Un blanco de 209 Bi es bombardeado por un haz de proyectiles de 54 Cr.

APLICACIONES Manganeso: - Preparación de aleaciones férreas y no férreas. Evita que el acero sea quebradizo. - Fertilizantes en pequeñas cantidades Tecnecio: - No tiene aplicaciones industriales y comerciales. - Artificial y radiactivo. Renio: refractario y resistente a la corrosión. - Joyería - Filamentos para espectrómetros de masas - catalizador en reacciones de hidrogenación y deshidrogenación.

¿SABIAS QUE ? El Mn es necesario para el crecimiento de los recién nacidos, La carencia de este el organismo puede generar lento crecimiento de uñas y cabellos, despigmentación del pelo, mala formación de huesos. El Diboruro de renio es mas duro que el diamante, dos factores contribuyen a la gran dureza del Re. B 2: una alta densidad de electrones de valencia y una abundancia de enlaces covalentes fuertes y cortos

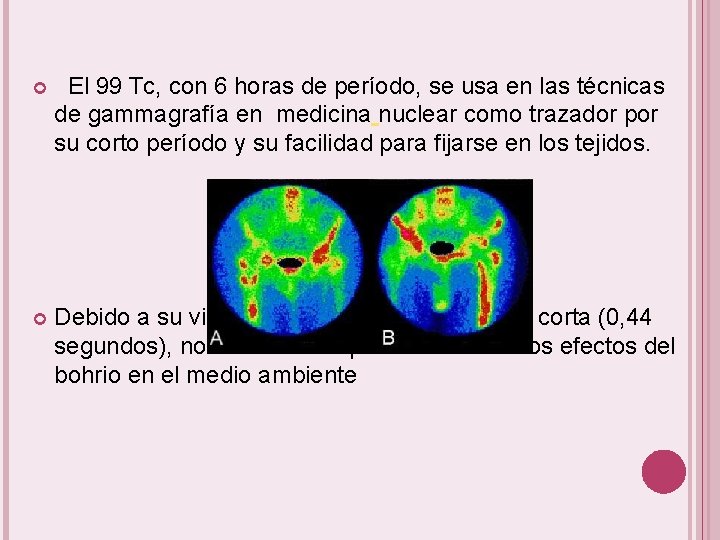
El 99 Tc, con 6 horas de período, se usa en las técnicas de gammagrafía en medicina nuclear como trazador por su corto período y su facilidad para fijarse en los tejidos. Debido a su vida media tan extremadamente corta (0, 44 segundos), no existe razón para considerar los efectos del bohrio en el medio ambiente

¡GRACIAS! FIN
 Orosz cintia nagy ő
Orosz cintia nagy ő Dr. orosz cintia
Dr. orosz cintia Mario ademar cruz cruz
Mario ademar cruz cruz Contactos sexo galicia
Contactos sexo galicia Sademario
Sademario Forem galicia
Forem galicia Ciszlajtánia
Ciszlajtánia Maravillas de galicia
Maravillas de galicia Galicia language
Galicia language Albert puigsech galicia
Albert puigsech galicia Estupian
Estupian Termos da oração
Termos da oração Luca
Luca Red nacional de laboratorios
Red nacional de laboratorios Miranda integrantes
Miranda integrantes Alejandra escudero
Alejandra escudero Incentro caracteristicas
Incentro caracteristicas Grupo 5 integrantes
Grupo 5 integrantes Termos integrantes da oração
Termos integrantes da oração Miss a integrantes
Miss a integrantes Integrantes de luca
Integrantes de luca Lagos integrantes
Lagos integrantes The internet integrantes
The internet integrantes Grupo de 4 integrantes
Grupo de 4 integrantes Estructura organizacional de pronaca
Estructura organizacional de pronaca Integrantes
Integrantes Evanescence integrantes
Evanescence integrantes My chemical romance discografia
My chemical romance discografia Metodo de crout
Metodo de crout Visita domiciliaria tipos
Visita domiciliaria tipos Paises mercosur
Paises mercosur Grupo 10 4 integrantes
Grupo 10 4 integrantes Tlc integrantes
Tlc integrantes Ley 045 mapa conceptual
Ley 045 mapa conceptual Integrantes de miranda
Integrantes de miranda Punto esquina
Punto esquina Trabaja en equipos de tres o cuatro integrantes
Trabaja en equipos de tres o cuatro integrantes Integrantes de una agencia de publicidad
Integrantes de una agencia de publicidad Integrantes da elo
Integrantes da elo Lagos integrantes
Lagos integrantes Forgiven integrantes
Forgiven integrantes Mapa mental sobre termos integrantes da oração
Mapa mental sobre termos integrantes da oração Uniones gap junction
Uniones gap junction Se despojó de su gloria
Se despojó de su gloria Paul sandhar-cruz
Paul sandhar-cruz No.me mueve mi dios para quererte
No.me mueve mi dios para quererte Cresta de la cruz de olvena
Cresta de la cruz de olvena En mes y año fue ordenado sacerdote pablo danei massari
En mes y año fue ordenado sacerdote pablo danei massari Bachillerato cruz azul
Bachillerato cruz azul Cuidado donde pones la cruz
Cuidado donde pones la cruz Ceca cruz azul
Ceca cruz azul Fraternidade rosacruz filiação
Fraternidade rosacruz filiação Yordanka reyes cruz
Yordanka reyes cruz