GLAVA 17 KOROZIJA I DEGRADACIJA Kljune stavke Zato






- Slides: 13

GLAVA 17: KOROZIJA I DEGRADACIJA Ključne stavke. . . • Zašto se javlja korozija ? • Koji metali korodiraju ? • Na koji način utiču temperatura i okolina na brzinu korozije ? • Kako sprečavamo koroziju ? Chapter 17 - 1

GUBICI USLED KOROZIJE • Korozija: --elektrohemijsko razaranje materijala --brod Al Kaponea, Sapona, blizu obale Biminija • Gubici: --4 to 5% bruto nacionalnog dohotka (GNP- u SAD) --ovo iznosi nešto preko $400 milijardi/god. Chapter 17 - 2

Mehanizam korozije (ljuštenjem) 4 Fe + 6 H 2 O + 3 O 2 4 Fe(OH)3 nastaje feri-hidroksid 2 Fe(OH)3 Fe 2 O 3 3 H 2 O nastaje fero-oksid (rđa) i voda Osnovni preduslovi za pojavu “rđe” ili korozije 1. Metal oksidiše na anodi elektrolitičke ćelije 2. Neki joni se redukuju na katodi 3. Javlja se potencijalna razlika ili napon između anode i katode 4. U prisustvu elektrolita (tečnost) 5. Elektronska putanja je zatvorena Chapter 17 - 2

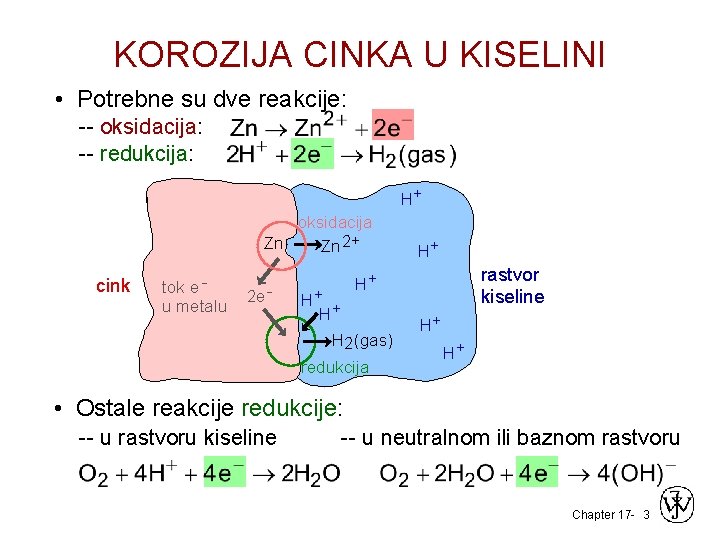
KOROZIJA CINKA U KISELINI • Potrebne su dve reakcije: -- oksidacija: -- redukcija: H+ oksidacija Zn Zn 2+ cink tok e u metalu 2 e - H+ H+ H+ rastvor kiseline H+ H 2(gas) redukcija H+ H+ • Ostale reakcije redukcije: -- u rastvoru kiseline -- u neutralnom ili baznom rastvoru Chapter 17 - 3

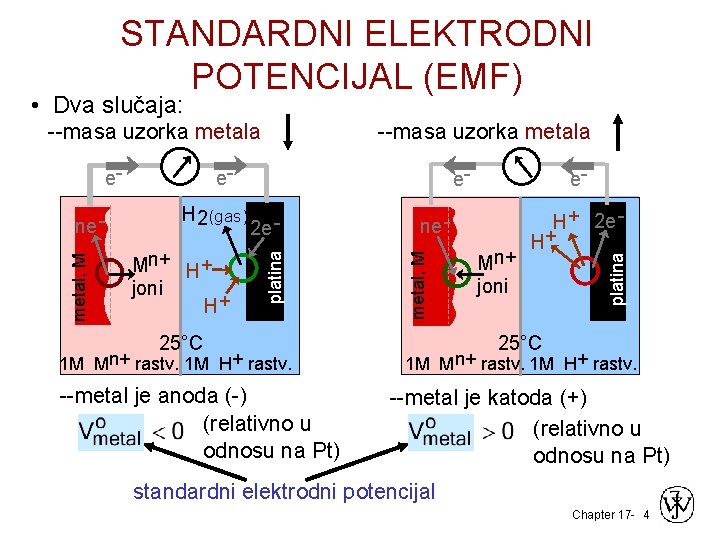
STANDARDNI ELEKTRODNI POTENCIJAL (EMF) • Dva slučaja: H 2(gas) Mn+ H+ joni H+ e 2 e - 25°C 1 M Mn+ rastv. 1 M H + rastv. --metal je anoda (-) (relativno u odnosu na Pt) e- ne metal, M ne - e- platina e- --masa uzorka metala Mn+ joni H+ 2 e H+ platina --masa uzorka metala 25°C 1 M Mn+ rastv. 1 M H+ rastv. --metal je katoda (+) (relativno u odnosu na Pt) standardni elektrodni potencijal Chapter 17 - 4

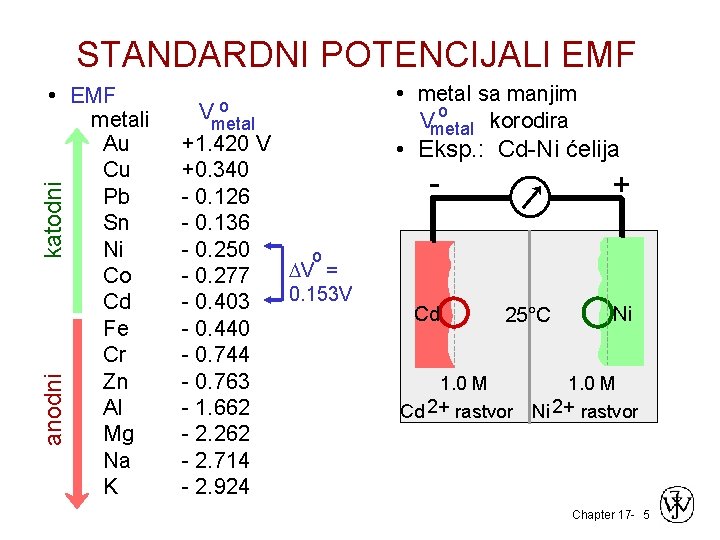
STANDARDNI POTENCIJALI EMF anodni katodni • EMF metali Au Cu Pb Sn Ni Co Cd Fe Cr Zn Al Mg Na K o Vmetal +1. 420 V +0. 340 - 0. 126 - 0. 136 - 0. 250 o DV = - 0. 277 0. 153 V - 0. 403 - 0. 440 - 0. 744 - 0. 763 - 1. 662 - 2. 262 - 2. 714 - 2. 924 • metal sa manjim o Vmetal korodira • Eksp. : Cd-Ni ćelija - Cd + 25°C Ni 1. 0 M Cd 2+ rastvor Ni 2+ rastvor Chapter 17 - 5

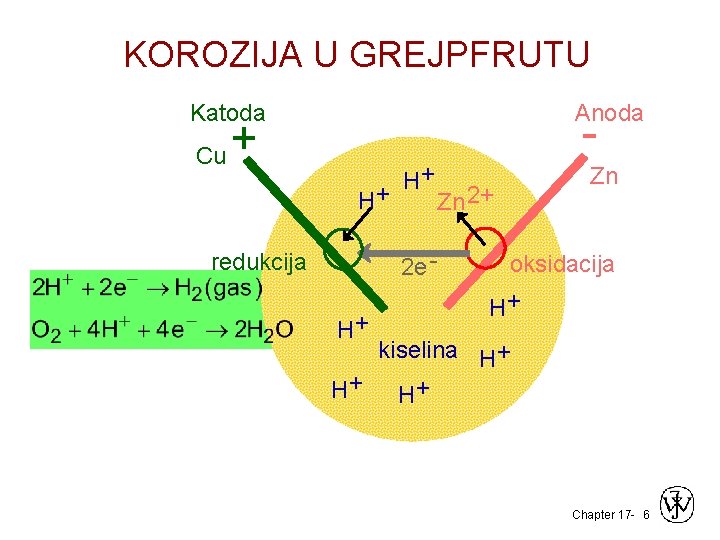
KOROZIJA U GREJPFRUTU Katoda Anoda - Cu + H+ H+ Zn 2+ 2 e - redukcija H+ Zn oksidacija H+ kiselina H+ H+ H+ Chapter 17 - 6

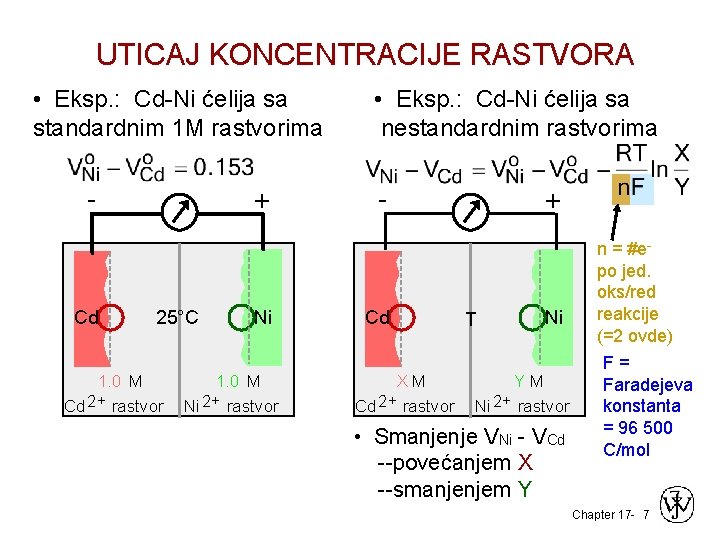
UTICAJ KONCENTRACIJE RASTVORA • Eksp. : Cd-Ni ćelija sa standardnim 1 M rastvorima - Cd + 25°C 1. 0 M Cd 2+ rastvor Ni 1. 0 M Ni 2+ rastvor • Eksp. : Cd-Ni ćelija sa nestandardnim rastvorima - Cd XM Cd 2+ rastvor + T Ni YM Ni 2+ rastvor • Smanjenje VNi - VCd --povećanjem X --smanjenjem Y n = #epo jed. oks/red reakcije (=2 ovde) F= Faradejeva konstanta = 96 500 C/mol Chapter 17 - 7

Faktori od uticaja na koroziju (ljuštenjem) Pasivizacija • primer sa čelikom u azotnoj kiselini … razblaženi rastvori izazivaju brzo dejstvo, jaki rastvori imaju manje vidljiv uticaj Metalurški faktori • može se formirati površinski • hemijska segregacija film • prisustvo više faza • kod nekih tipova čelika se • uključci javlja sa rđom • obrada hladnim deformisanjem • neravnomerna raspodela napona • javlja se i kod aluminijuma • potrebno je uočiti film od pasiviziranja, a može se koristiti kao jednostavna zaštita • • osobine materijala metalurški faktori pasivizacija sredina Chapter 17 - 2

GALVANSKI NIZ anodni (aktivni) katodni (inertni) • Prema reaktivnosti metala/legura u morskoj vodi Platina Zlato Grafit Titan Srebro 316 nerđajući čelik (ASTM) (pasivan) Nikal (pasivan) Bakar Nikal (aktivan) Kalaj Olovo 316 nerđajući čelik (ASTM) (aktivan) Liveno gvožđe Gvožđe/Čelik Legure aluminijuma Kadmijum Cink Magnezijum Chapter 17 - 8

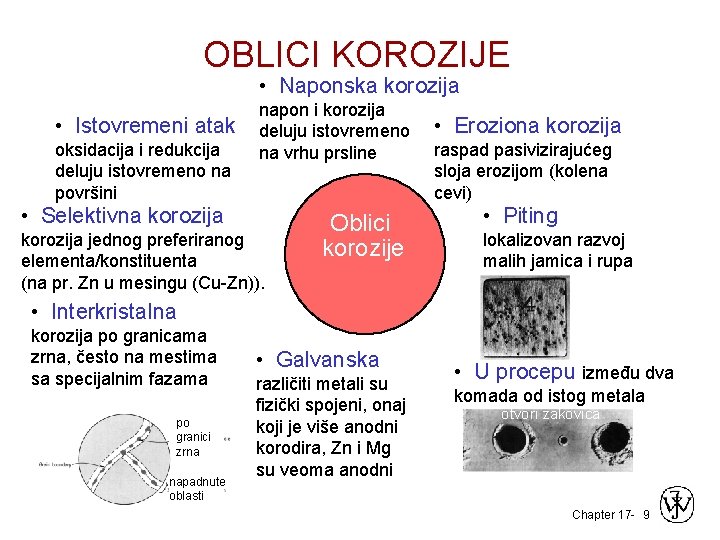
OBLICI KOROZIJE • Naponska korozija • Istovremeni atak oksidacija i redukcija deluju istovremeno na površini napon i korozija deluju istovremeno na vrhu prsline • Selektivna korozija jednog preferiranog elementa/konstituenta (na pr. Zn u mesingu (Cu-Zn)). Oblici korozije • Eroziona korozija raspad pasivizirajućeg sloja erozijom (kolena cevi) • Piting lokalizovan razvoj malih jamica i rupa • Interkristalna korozija po granicama zrna, često na mestima sa specijalnim fazama po granici zrna napadnute oblasti • Galvanska različiti metali su fizički spojeni, onaj koji je više anodni korodira, Zn i Mg su veoma anodni • U procepu između dva komada od istog metala otvori zakovica Chapter 17 - 9

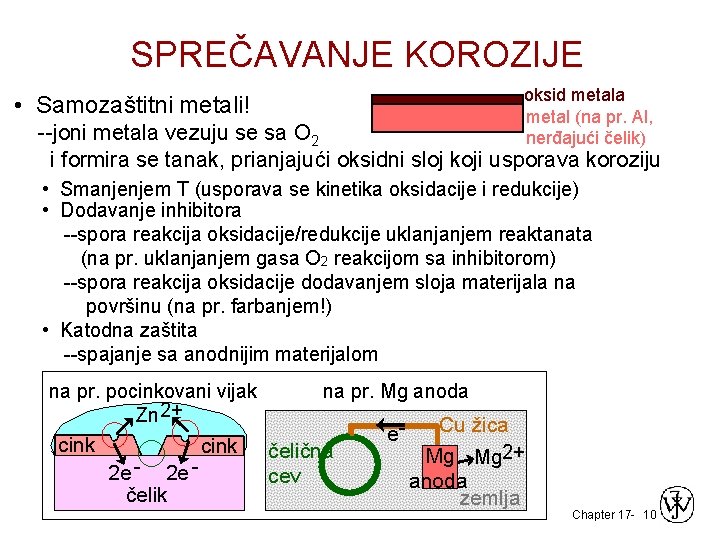
SPREČAVANJE KOROZIJE oksid metala metal (na pr. Al, nerđajući čelik) • Samozaštitni metali! --joni metala vezuju se sa O 2 i formira se tanak, prianjajući oksidni sloj koji usporava koroziju • Smanjenjem T (usporava se kinetika oksidacije i redukcije) • Dodavanje inhibitora --spora reakcija oksidacije/redukcije uklanjanjem reaktanata (na pr. uklanjanjem gasa O 2 reakcijom sa inhibitorom) --spora reakcija oksidacije dodavanjem sloja materijala na površinu (na pr. farbanjem!) • Katodna zaštita --spajanje sa anodnijim materijalom na pr. pocinkovani vijak Zn 2+ cink 2 e - 2 e čelik cink na pr. Mg anoda čelična cev e- Cu žica Mg Mg 2+ anoda zemlja Chapter 17 - 10

REZIME • Korozija nastaje usled: --prirodne tendencije metala koji otpuštaju elektrone --elektroni se otpuštaju reakcijom oksidacije --ovi elektroni zatim učestvuju u reakciji redukcije • Metali negativnijeg Standardnog Elektrodnog Potencijala su podložniji ka koroziji u odnosu na druge metale • Galvanski niz daje reaktivnost metala u morskoj vodi • Porastom T se ubrzavaju reakcije oksidacije/redukcije • Korozija se sprečava: -- upotrebom metala koji stvaraju zaštitni oksidni sloj -- dodavanjem inhibitora -- sniženjem T -- farbanjem -- katodnom zaštitom Chapter 17 - 11