FOTOCATALIZA ETEROGEN Fotocatalizatorii sunt semiconductori cu o structur










- Slides: 17

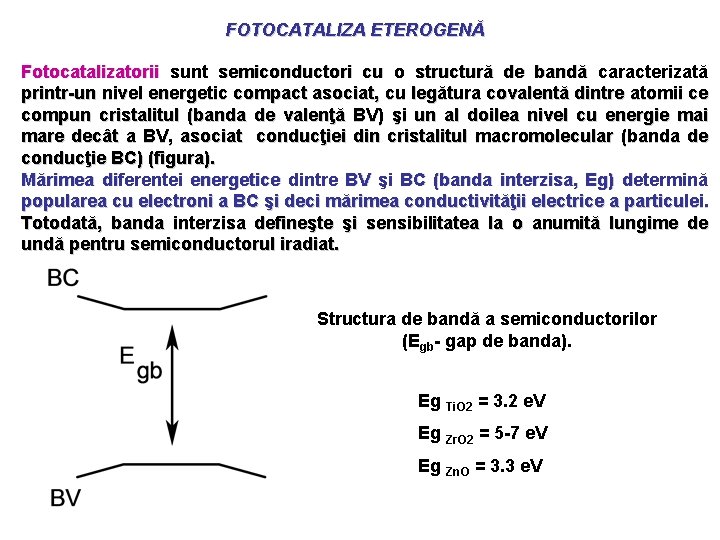
FOTOCATALIZA ETEROGENĂ Fotocatalizatorii sunt semiconductori cu o structură de bandă caracterizată printr-un nivel energetic compact asociat, cu legătura covalentă dintre atomii ce compun cristalitul (banda de valenţă BV) şi un al doilea nivel cu energie mai mare decât a BV, asociat conducţiei din cristalitul macromolecular (banda de conducţie BC) (figura). Mărimea diferentei energetice dintre BV şi BC (banda interzisa, Eg) determină popularea cu electroni a BC şi deci mărimea conductivităţii electrice a particulei. Totodată, banda interzisa defineşte şi sensibilitatea la o anumită lungime de undă pentru semiconductorul iradiat. Structura de bandă a semiconductorilor (Egb- gap de banda). Eg Ti. O 2 = 3. 2 e. V Eg Zr. O 2 = 5 -7 e. V Eg Zn. O = 3. 3 e. V

Fotocataliza eterogenă este procesul catalitic eterogen care loc la interfaţa solid-lichid sau solid-gaz, în care catalizatorul este activat de o radiaţie incidentă, a cărei energie trebuie să fie mai mare decât gapul energetic (Egp). Acest procedeu are aplicabilitate în două domenii ale fotochimiei: sinteza organică şi degradarea poluanţilor organici şi anorganici. Faţă de fotoliză, fotocataliza eterogenă prezintă două avantaje majore: nu necesită etape suplimentare care să finalizeze procesul de oxidare şi este un procedeu ieftin care nu necesită prezenţa unor oxidanţi costisitori cum ar fi H 2 O 2 sau O 3. Procedeul fotocatalitic eterogen se foloseşte cu succes şi la descompunerea precursorilor trihalogenometanici utilizaţi la dezinfecţia prin clorurare a apei potabile. Aceşti halogenoderivaţi sunt substanţe puternic mirositoare care dau apei potabile gust şi miros caracteristic.

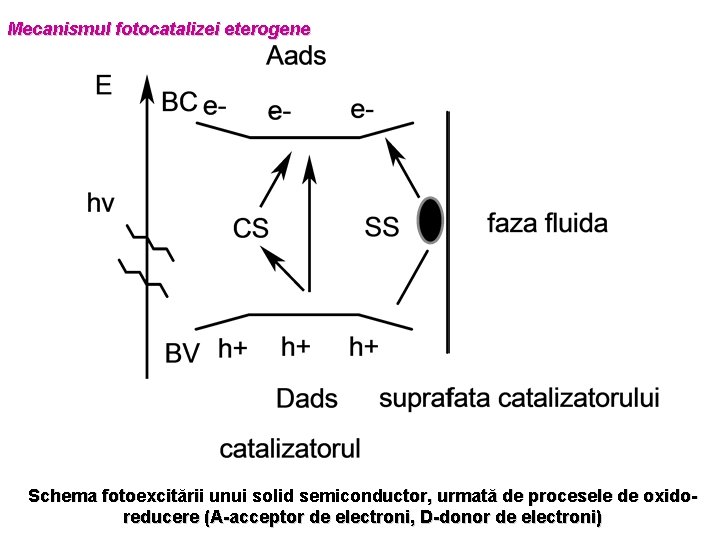
Mecanismul fotocatalizei eterogene Schema fotoexcitării unui solid semiconductor, urmată de procesele de oxidoreducere (A-acceptor de electroni, D-donor de electroni)

- Fotoexcitarea semiconductorului cu o radiaţie incidentă cu o energie mai mare decât Egb determină promovarea electronilor din BV în BC, creând în BV vacanţe sau goluri -electronii din BC reacţioneaza cu acceptori de electroni (O 2, H 2 O 2, ioni metalici) (reactiile 1 si 2) - golurile din BV reactioneaza cu donorii de electroni (HO-, H 2 O 2) (reactiile 3, 4, 5) - proces nedorit – recombinarea purtatorilor de sarcina cu eliberare de energie termică sau radiaţie luminoasă; poate avea loc fie pe suprafaţa particulei (procesul A), fie în interiorul particulei (procesul B) reactia 1 reactia 2 reactia 3 reactia 4 reactia 5

Factori care influenţează procesul fotocatalitic eterogen 1. Adsorbţia reactanţilor pe suprafaţa fotocatalizatorului -Deoarece recombinarea sarcinilor este foarte rapidă, transferul electronic inter facial este posibil doar dacă donorul sau acceptorul de sarcină sunt adsorbit i pe suprafaţa semiconductorului -Densitatea grupărilor HO- pe suprafaţa oxizilor metalici este 4 -5 molecule/nm 2 -Acestea se pot asocia pe suprafaţă, formând zone cu acidităţi diferite, pe care adsorbţia se realizează diferit. -Importanţa preadsorbţiei substratului pe fotocatalizator a fost demostrată cu ajutorul modelului cinetic Langmuir-Hinshelwood, modificat pentru reacţii ce au loc la interfaţa solid-lichid; - presupune că: - numărul de centre de adsorbţie este constant; - pe un centru se poate adsorbi doar o moleculă de substrat; - energia de adsorbţie a substratului este identică pentru fiecare centru şi independentă de gradul de acoperire a suprafeţei; - nu există interacţii între moleculele adsorbite; - viteza de adsorbţie este mai mare decât viteza de reacţie şi adsorbţia nu este ireversibilă Unde: θ- gradul de acoperire al suprafeţei, K- constanta de echilibru, C- concentraţia substratului

2. Modificarea semiconductorului Natura semiconductorului are un rol foarte important în activitatea şi selectivitatea reacţiilor fotocatalitice. Proprietăţile suprafeţei influenţează viteza şi modul de adsorbţie al reactanţilor şi produşilor de reacţie, activarea sau scindarea legăturilor chimice, stereochimia compuşilor formaţi şi mobilitatea reactanţilor, a intermediarilor şi a produşilor de reacţie. Suprafaţa semiconductorului poate fi modificată prin dopare cu ioni metalici, depunere de metale, cuplare cu alţi semiconductori sau specii oxidice şi prin sensibilizare cu coloranţi.

Particulă de fotocatalizator modificată prin depunerea metalului

Fotoexcitarea catalizatorului compozit Cd. S – Ti. O 2

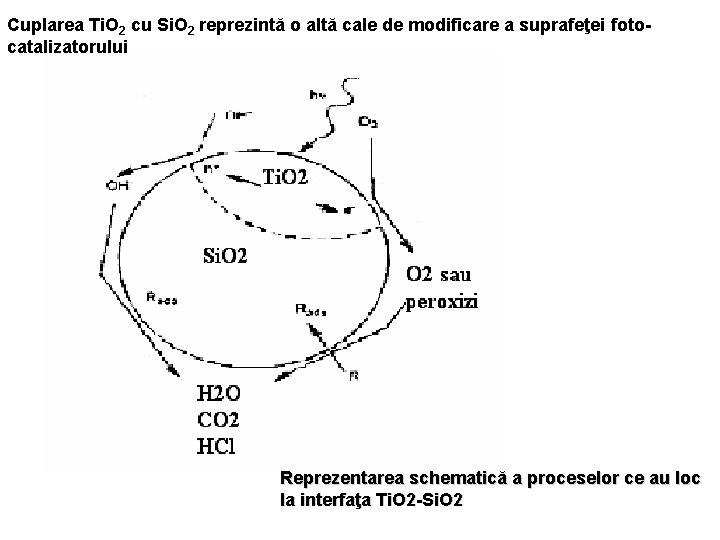
Cuplarea Ti. O 2 cu Si. O 2 reprezintă o altă cale de modificare a suprafeţei fotocatalizatorului Reprezentarea schematică a proceselor ce au loc la interfaţa Ti. O 2 -Si. O 2

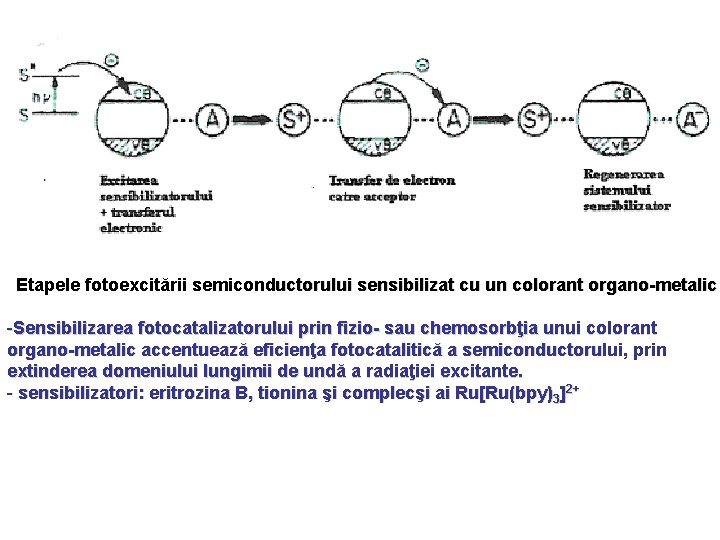
Etapele fotoexcitării semiconductorului sensibilizat cu un colorant organo-metalic -Sensibilizarea fotocatalizatorului prin fizio- sau chemosorbţia unui colorant organo-metalic accentuează eficienţa fotocatalitică a semiconductorului, prin extinderea domeniului lungimii de undă a radiaţiei excitante. - sensibilizatori: eritrozina B, tionina şi complecşi ai Ru[Ru(bpy)3]2+

3. Randamentul cuantic şi energetic - randamente cuantice mici - moleculele activate de lumină se dezactivează fie prin reemiterea fotonului, fie prin pierderea neradiantă a surplusului de energie, proces care nu conduce la reacţie - randamente cuantice foarte mari Ф » 1 - prezenţa unor reacţii înlănţuite in procesul de formare a produşilor.

4. Caracteristicile optice ale radiatiei excitante Viteza fotocatalizei eterogene depinde în mare măsură de fluxul radiant şi implicit de lungimea de undă. Deoarece Eg a Ti. O 2 este de ~3, 2 e. V, acesta poate fi fotoexcitat doar de o radiaţie cu lungime de undă mai mică de 400 nm, adică aparţinând domeniului UV. Dependenţa vitezei de reacţie de fluxul radiant

5. Concentraţia O 2 din mediul de reacţie O 2 din faza lichidă, unde este dizolvat în conformitate cu legea lui Henry, se adsoarbe pe Ti. O 2 şi ulterior, descompune reactantul A la produs P. Dacă furnizarea de O 2 este constantă, se presupune că şi gradul de acoperire a suprafeţei cu oxigen este constant şi poate fi integrat într-o constantă aparentă de viteză: unde: θA – gradul de acoperire a suprafeţei cu A, θO 2 – gradul de acoperire a suprafeţei cu O 2, kapp-constanta aparentă

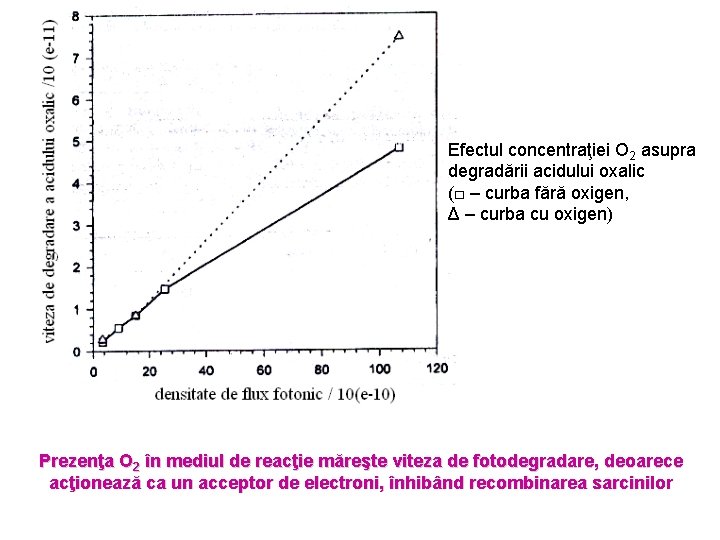
Efectul concentraţiei O 2 asupra degradării acidului oxalic (□ – curba fără oxigen, Δ – curba cu oxigen) Prezenţa O 2 în mediul de reacţie măreşte viteza de fotodegradare, deoarece acţionează ca un acceptor de electroni, înhibând recombinarea sarcinilor

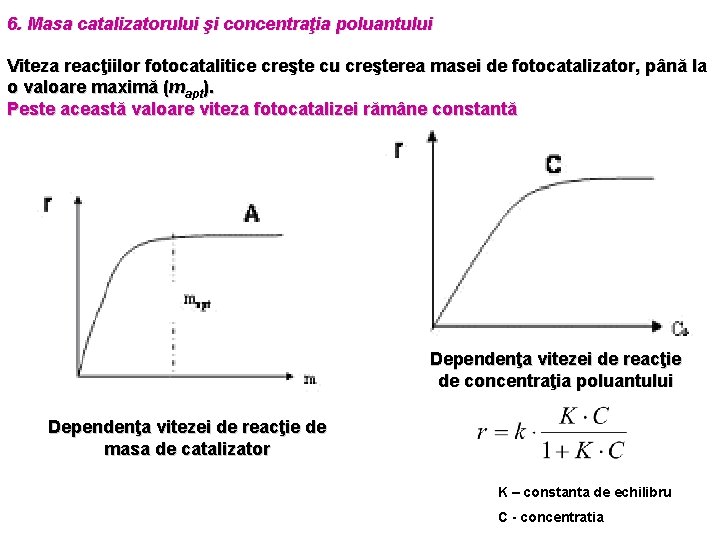
6. Masa catalizatorului şi concentraţia poluantului Viteza reacţiilor fotocatalitice creşte cu creşterea masei de fotocatalizator, până la o valoare maximă (mapt). Peste această valoare viteza fotocatalizei rămâne constantă Dependenţa vitezei de reacţie de concentraţia poluantului Dependenţa vitezei de reacţie de masa de catalizator K – constanta de echilibru C - concentratia

7. p. H-ul mediului - mediu acid - viteza de fotodegradare a substraturilor organice scade, datorită cuplării nedorite a electronilor fotogeneraţi cu protonii din mediu, scăzând astfel randamentul cuantic. Mai mult, protonii se fixează pe suprafaţa catalizatorului, pozitivând-o şi nepermiţând fixarea reactanţilor. - mediu bazic - scade viteza reacţiei fotocatalitice, deoarece suprafaţa Ti. O 2 este încărcată negativ şi ca urmare se adsorb pe suprafaţă numai cationii din soluţie

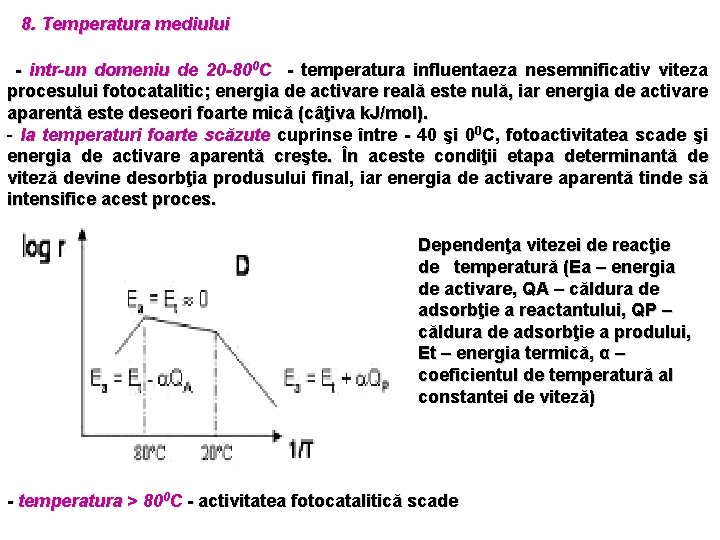
8. Temperatura mediului - intr-un domeniu de 20 -800 C - temperatura influentaeza nesemnificativ viteza procesului fotocatalitic; energia de activare reală este nulă, iar energia de activare aparentă este deseori foarte mică (câţiva k. J/mol). - la temperaturi foarte scăzute cuprinse între - 40 şi 00 C, fotoactivitatea scade şi energia de activare aparentă creşte. În aceste condiţii etapa determinantă de viteză devine desorbţia produsului final, iar energia de activare aparentă tinde să intensifice acest proces. Dependenţa vitezei de reacţie de temperatură (Ea – energia de activare, QA – căldura de adsorbţie a reactantului, QP – căldura de adsorbţie a prodului, Et – energia termică, α – coeficientul de temperatură al constantei de viteză) - temperatura > 800 C - activitatea fotocatalitică scade
 Fotocataliza
Fotocataliza Semiconductori intrinseci
Semiconductori intrinseci Dna structur
Dna structur Cand sunt mic atunci sunt mare
Cand sunt mic atunci sunt mare Care sunt simturile prin care sunt evocate
Care sunt simturile prin care sunt evocate Eu sunt micul gradinar
Eu sunt micul gradinar Nivele de comunicare
Nivele de comunicare Doua corpuri punctiforme incarcate cu sarcinile electrice
Doua corpuri punctiforme incarcate cu sarcinile electrice Virusurile sunt organisme unicelulare
Virusurile sunt organisme unicelulare Text literar si nonliterar exemple
Text literar si nonliterar exemple Lavabatur in villa formiana
Lavabatur in villa formiana Ce sunt viciile
Ce sunt viciile Glucoza formula chimica
Glucoza formula chimica Nu pot veni azi la ospat sunt foarte ocupat
Nu pot veni azi la ospat sunt foarte ocupat Inmultirea lichenilor
Inmultirea lichenilor Schema optica a microscopului
Schema optica a microscopului Quot nummi sunt in sacculo iulii
Quot nummi sunt in sacculo iulii Care sunt gradele de comparatie
Care sunt gradele de comparatie