Fasta mnen solidus 1 Metaller 2 Jonfreningar 3






- Slides: 12

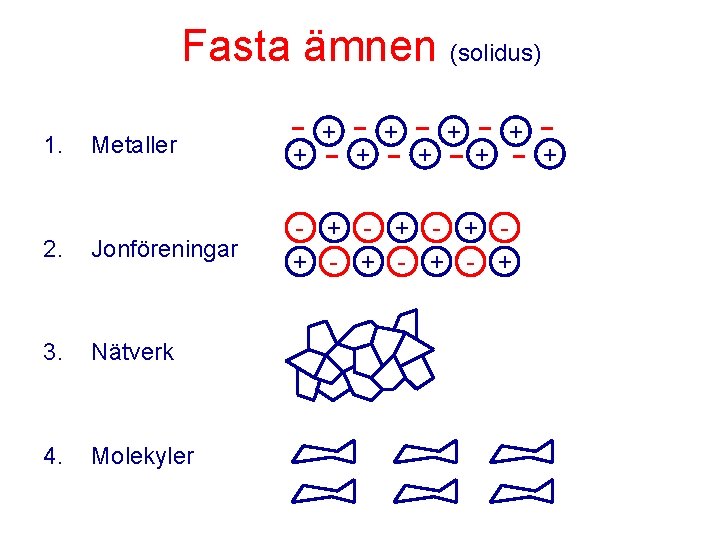
Fasta ämnen (solidus) 1. + + Metaller + 2. Jonföreningar - + - + - + 3. Nätverk 4. Molekyler + +

Bindningar i fasta ämnen Starka kemiska bindningar: Jon – jon Na. Cl, Ba. SO 4 Jon – dipol Kovalent Metall Cu. SO 4 · 5 H 2 O diamant Mg, Fe 100~400 k. J/mol Svaga kemiska bindningar: Dipol – dipol H 2 S Vätebindning Londonkraft (van der Waals) H 2 O P 4 30~100 k. J/mol 5~25 k. J/mol

Smältpunkter och kokpunkter: Jonföreningar har ofta höga smp. och kp: Ex. Mg. O smp. 2800°c, kokpunkt 3600°c Al 2 O 3 smp. 2015°c, kokpunkt 2980°c gitterenergi

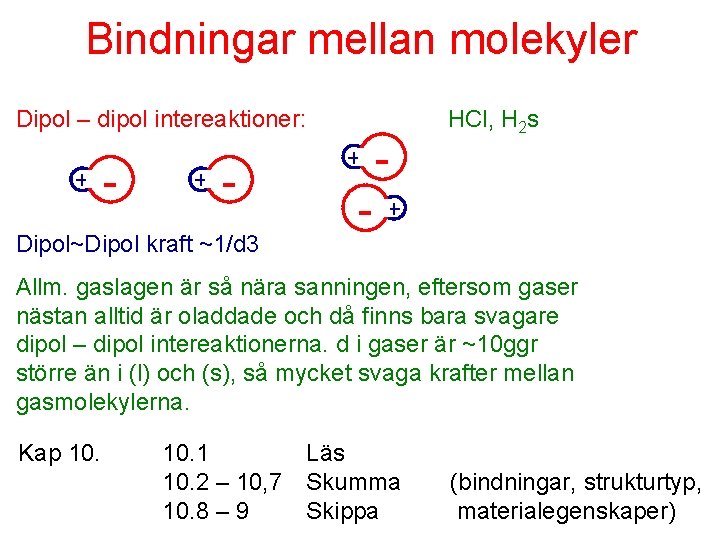
Bindningar mellan molekyler Dipol – dipol intereaktioner: + - Dipol~Dipol kraft ~1/d 3 + - - HCl, H 2 s + Allm. gaslagen är så nära sanningen, eftersom gaser nästan alltid är oladdade och då finns bara svagare dipol – dipol intereaktionerna. d i gaser är ~10 ggr större än i (l) och (s), så mycket svaga krafter mellan gasmolekylerna. Kap 10. 1 10. 2 – 10, 7 10. 8 – 9 Läs Skumma Skippa (bindningar, strukturtyp, materialegenskaper)

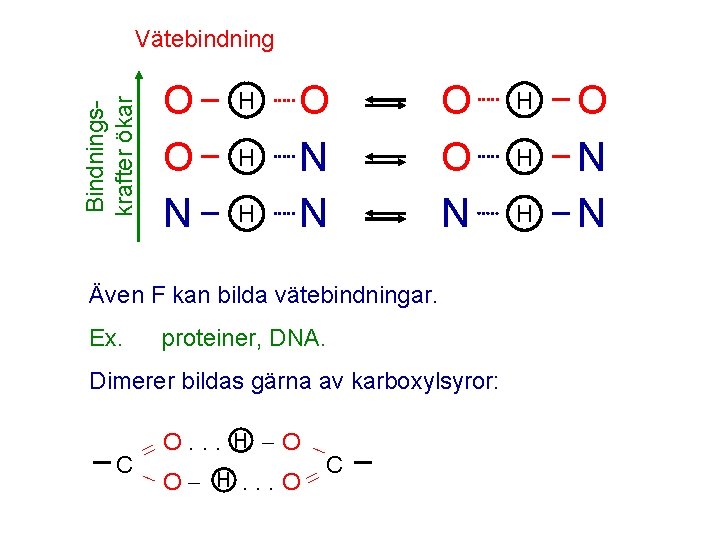
Vätebindning Bindningskrafter ökar O O N H H H O N N O O N Även F kan bilda vätebindningar. Ex. proteiner, DNA. Dimerer bildas gärna av karboxylsyror: O. . . H O C C H O . . . O H H H O N N

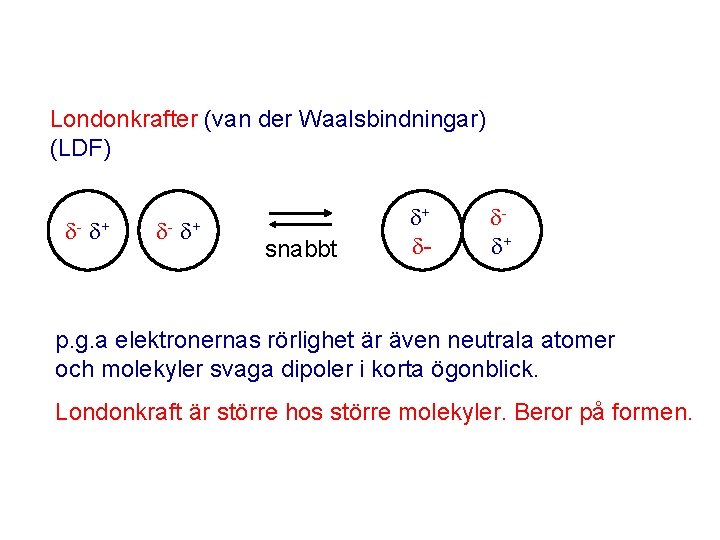
Londonkrafter (van der Waalsbindningar) (LDF) - + snabbt + - + p. g. a elektronernas rörlighet är även neutrala atomer och molekyler svaga dipoler i korta ögonblick. Londonkraft är större hos större molekyler. Beror på formen.

Smältpunkter och kokpunkter ökar med bindningskrafter mellan molekyler/atomer. Ämne He LDF Xe CO 2 Dipol H N 2 S -bindn. H 2 O smp (°c) -270 -259 -112 -210 — -86 0 kp (°c) -269 H 2 -253 -108 N 2 -196 -79 s -60 100

Vätskor — flyter, bildar en skarp yta, avdunstar. Viskositet: Vatten låg, sirap hög Ytspänning: Kapillärkraft Adsorption = molekyler binder till en yta. H 2 O Ångtryck Hg Prapor med T. Vätebindningar lägre ångtryck

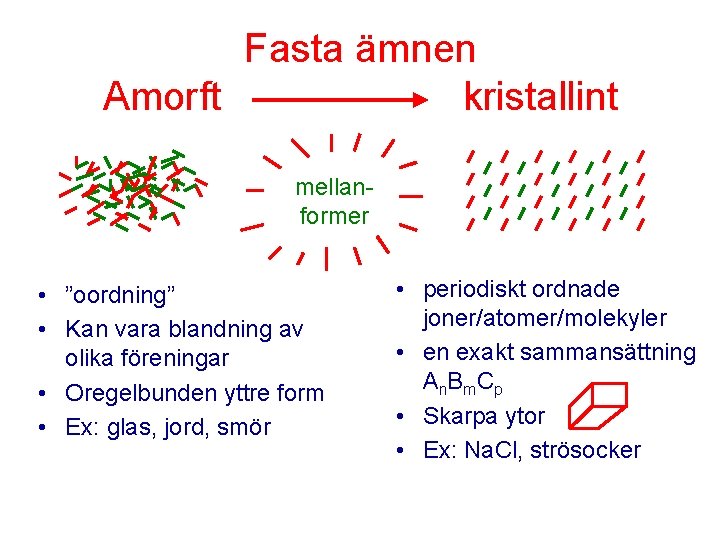
Fasta ämnen Amorft kristallint mellanformer • ”oordning” • Kan vara blandning av olika föreningar • Oregelbunden yttre form • Ex: glas, jord, smör • periodiskt ordnade joner/atomer/molekyler • en exakt sammansättning A n B m. C p • Skarpa ytor • Ex: Na. Cl, strösocker

Röntgendiffraktion Kristallografi Röntgenstrålning = elektromagnetisk strålning = 1 - 2Å 1912 -30 50 70 99 Na. Cl Bragg och Bragg 1920 Enkla oxider och salter (2 -10 atomer/cell) 1940 Organiska föreningar (10 -20 atomer/cell) 1969 Större organiska + proteiner (100 -1000 atomer) 1980 Virus (1 000 atomer) 2000 Ribosomen

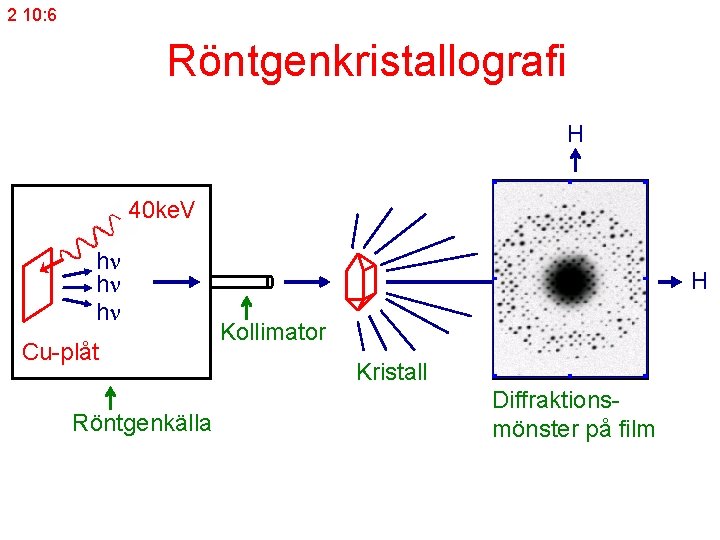
2 10: 6 Röntgenkristallografi H 40 ke. V h h h Cu-plåt Röntgenkälla H Kollimator Kristall Diffraktionsmönster på film

Ur diffraktionsmönstret avläses: • Symmetrin • Enhetscellens storlek Ur de relativa intensiteterna kan man bestämma: • Atomkoordinaterna i 3 D Rasmol på datorn Noggranhet: 0, 001Å 0, 1Å oorganiska proteiner Om antalet atomer i enhetscellen ökar med faktorn n, då ökar enhetscellens volym med faktorn n, och då ökar antalet diffraktionspunkter med faktorn n. Strukturbas Protein Data Base PDB