Enlace qumico Menor energa de ionizacin Mayor afinidad



- Slides: 7

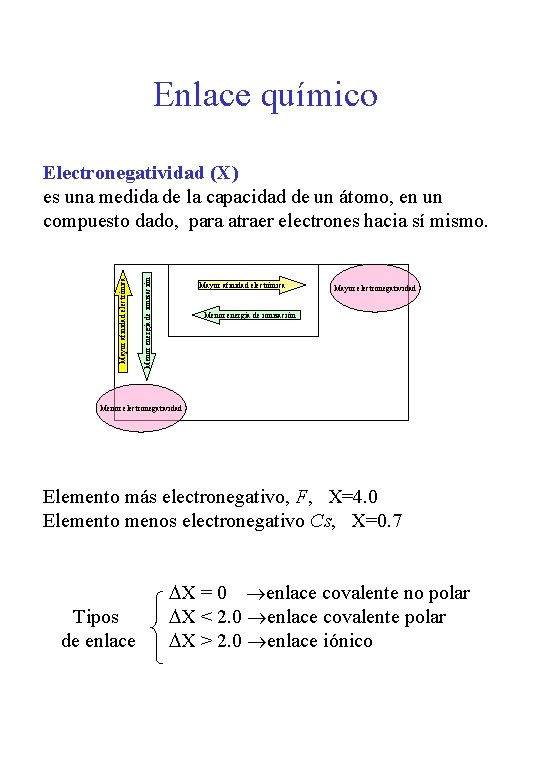
Enlace químico Menor energía de ionización Mayor afinidad electrónica Electronegatividad (X) es una medida de la capacidad de un átomo, en un compuesto dado, para atraer electrones hacia sí mismo. Mayor afinidad electrónica Mayor electronegatividad Menor energía de ionización Menor electronegatividad Elemento más electronegativo, F, X=4. 0 Elemento menos electronegativo Cs, X=0. 7 Tipos de enlace DX = 0 enlace covalente no polar DX < 2. 0 enlace covalente polar DX > 2. 0 enlace iónico

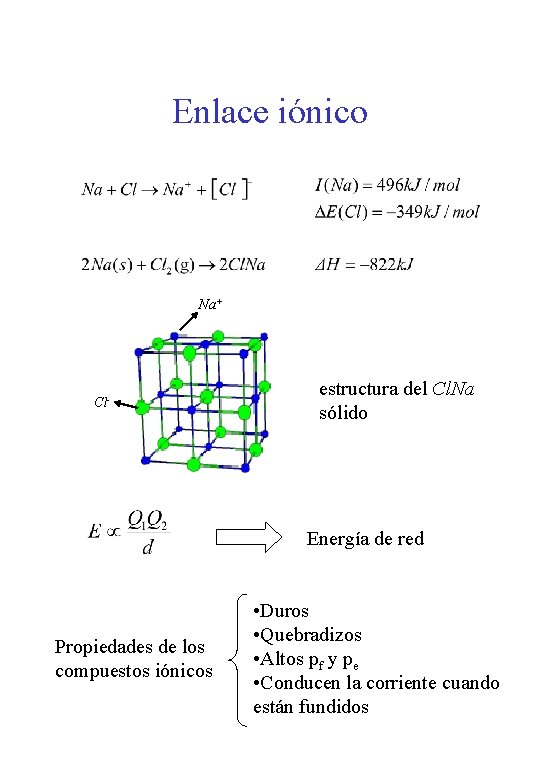
Enlace iónico Na+ Cl- estructura del Cl. Na sólido Energía de red Propiedades de los compuestos iónicos • Duros • Quebradizos • Altos pf y pe • Conducen la corriente cuando están fundidos

Enlace covalente H H H 2 F F F 2 O F H H H N H H C H H Polaridad de enlace H +d F -d H H H enlace polar enlace no polar Enlaces múltiples O O O 2 N N N 2 Propiedades de los compuestos moleculares • Bajos pf y pe • No conducen la corriente cuando están fundidos

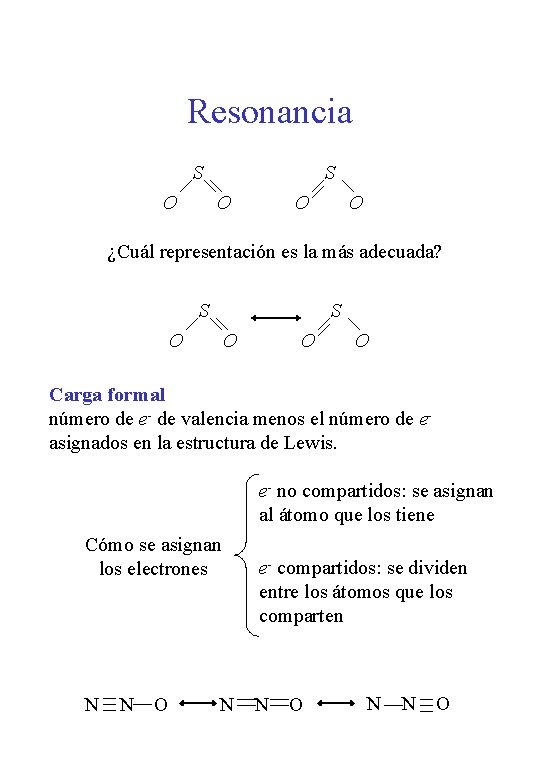
Resonancia S O O O ¿Cuál representación es la más adecuada? S S O O Carga formal número de e- de valencia menos el número de easignados en la estructura de Lewis. e- no compartidos: se asignan al átomo que los tiene Cómo se asignan los electrones N N O N e- compartidos: se dividen entre los átomos que los comparten N O N N O

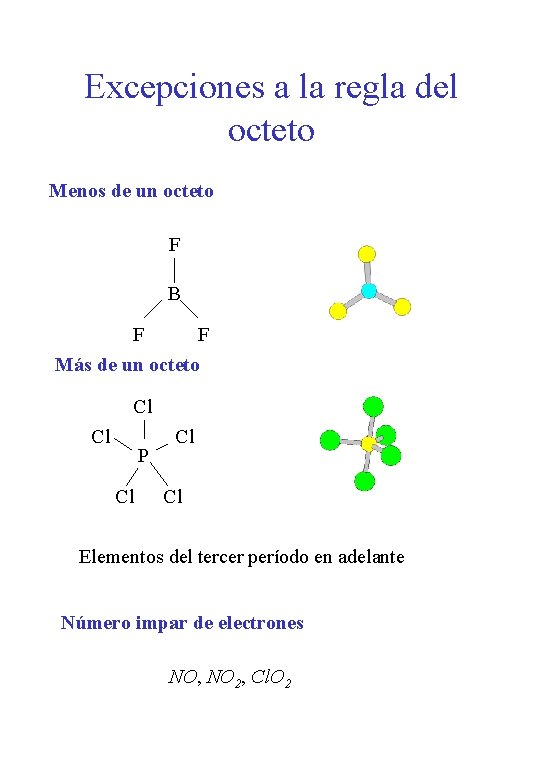
Excepciones a la regla del octeto Menos de un octeto F B F F Más de un octeto Cl Cl P Cl Cl Cl Elementos del tercer período en adelante Número impar de electrones NO, NO 2, Cl. O 2

Número de oxidación Es la carga que el átomo tendría en el compuesto, si el compuesto fuera iónico • Es cero en cualquier sustancia neutra que contiene átomos de un solo elemento (ej: H 2, O 2, Al, S 8). • Es igual a la carga del ion en iones que contienen átomos de un solo elemento (ej: para Ca++ = 2). • Es igual a +1 para el H cuando este se combina con un elemento más electronegativo (ej: H 2 O, SH 2). • Es igual a -1 para el H cuando este se combina con un elemento menos electronegativo (ej: Li. H, Ca. H 2) • Es igual a -2 para casi todos los compuestos del O, excepto los peróxidos y superóxidos. • Los elementos de los grupos IA y IIA tienen números de oxidación +1 y +2, respectivamente. • Los elementos del grupo VIIA tienen número de oxidación -1 cuando se unen a un elemento menos electronegativo. • La suma de los números de oxidación de una molécula neutra es igual a cero. • La suma de los números de oxidación de un ion molecular es igual a la carga del ion.

Pasos para escribir la estructura de Lewis de una molécula • Escribir el esqueleto de la estructura de la molécula. • Determinar el número de electrones de valencia de la molécula. • Usar dos electrones de valencia para cada enlace en la molécula. • Distribuir los electrones remanentes tratando de colocar ocho electrones alrededor de cada átomo. Nota: si uno de los átomos enlazados es C, N, O, P o S, es posible escribir una estructura con enlaces dobles o triples.













