ELEKTROCHEMIE Pi elektrolze putuj kladn ionty kationty k












- Slides: 14

ELEKTROCHEMIE

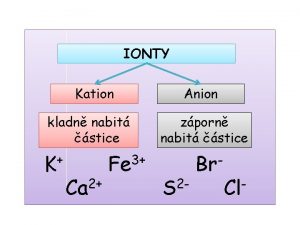
Při elektrolýze putují kladné ionty (kationty) k záporné elektrodě (katodě) a záporné ionty (anionty) ke kladné elektrodě (anodě) Na katodě probíhá redukce: Na + + elektron = Na Na anodě probíhá oxidace: Cl - - elektron = Cl

Faradayovy zákony: 1. Hmota vyloučené látky při elektrolýze je přímo úměrná prošlému náboji. 2. Hmoty různých látek vyloučené týmž nábojem jsou chemicky ekvivalentní. Při elektrolýze potřebujeme na vyloučení 1 gramionu množství elektřiny: N. e (N je Avogadrovo číslo, e náboj elektronu) N. e = F (Faradayova konstanta, 1 Faraday = 96 494 Coulombů) Práce, kterou proud vykoná je dána: w=F. DE

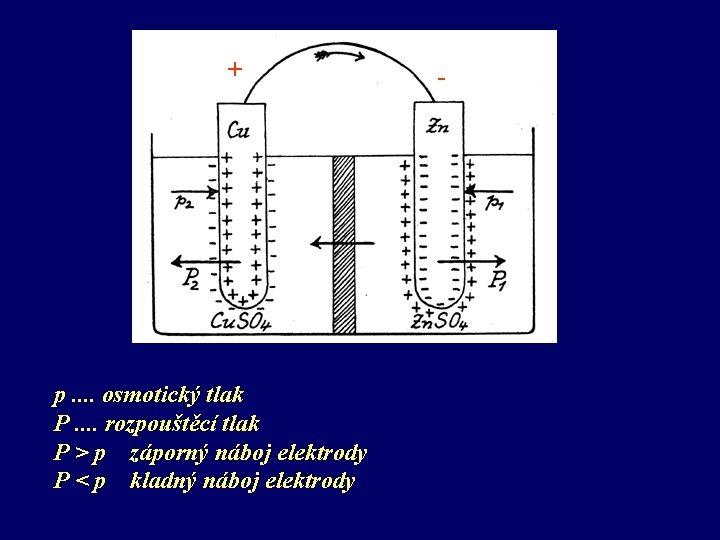
Elektrochemický článek se skládá ze dvou poločlánků, tvořených např. kovovou elektrodou ponořenou do roztoku iontu elektrodového kovu. Poločlánky jsou navzájem vodivě propojeny, např. solným můstkem. V každém poločlánku se nachází oxidovaná a redukovaná složka, které spolu vytvářejí redox pár.

+ p. . osmotický tlak P. . rozpouštěcí tlak P > p záporný náboj elektrody P < p kladný náboj elektrody -

Vodíková elektroda Vzácné kovy jako platina a palladium pohlcují intenzivně vodík. Přitom se vytváří pevný roztok, analogický slitinám. V něm je vodík přítomen v atomovém stavu, nikoliv jako molekula, a má tedy vlastnosti kovu. Ponoříme-li platinovou černí potaženou elektrodu , sycenou proudem vodíku do roztoku, díky rozpouštěcímu tlaku se budou uvolňovat protony, dokud se nevyrovnají osmotickému tlaku. Tak vzniká potenciál, závislý na parciálním tlaku vodíku. Normální vodíková elektroda se realizuje za podmínek [ H+] = 1 (tzn. p. H = 0) a tlaku vodíku 1 atm. Na základě úmluvy se stanovil její potenciál roven 0

Srovnáním potenciálu poločlánku tvořeného kovem ponořeným do 1 N roztoku své soli s potenciálem normální vodíkové elektrody získáme řadu napětí kovů. Některé příklady: Elektroda Li/Li+ K/K+ Na/Na+ Zn/Zn 2+ Fe/Fe 3+ H/H+ Cu/Cu 2+ Cu/Cu+ Ag/Ag+ Au/Au+ Potenciál (Volt) - 3, 02 - 2, 92 - 2, 71 - 0, 76 - 0, 43 - 0, 04 0, 00 + 0, 34 + 0, 51 + 0, 80 + 1, 50

Kovy, které jsou před vodíkem mají tendenci vytvářet pozitivní kationty a se vzdáleností od vodíku roste jejich elektropozitivita Elektropozitivnější kov vylučuje z roztoku kov méně elektropozitivní. Potenciál kovové elektrody, jež vysílá do roztoku kationty je dán Nernstovou rovnicí: E = - RT/n. F. ln c kde R. . . univerzální konstanta n. . . počet elektronů tvořících rozdíl mezi kovem a iontem c. . . koncentrace iontu

Pro vyjádření množství energie uvolněné při elektrochemickém procesu můžeme použít vztah: DG = - n. FE Za standardních podmínek (1 M koncentrace, tlak 1 atm) dostáváme: DG 0 = - n. FE 0 . . . . standardní potenciál článku Standardní potenciál článku se může odvodit jako součet standardních potenciálů elektrod: E 0 = E 0(anody) + E 0(katody)

Množství uvolněné energie za standardních podmínek si můžeme vyjádřit v obecné formě: DG 0 = - RT ln. K Další vyjádření máme pro elektrodový proces: DG 0 = - n. FE 0 Když budeme uvažovat reálný proces mimo standardní podmínky, tak: DG = DG 0 + RT ln. Q kde Q odpovídá aktuálnímu poměru produktů a reaktantů. Pro elektrodový potenciál dostaneme: -n. FE = -n. FE 0 + RT ln. Q a odtud E = E 0 - RT/n. F ln Q což je důležité vyjádření Nernstovy rovnice

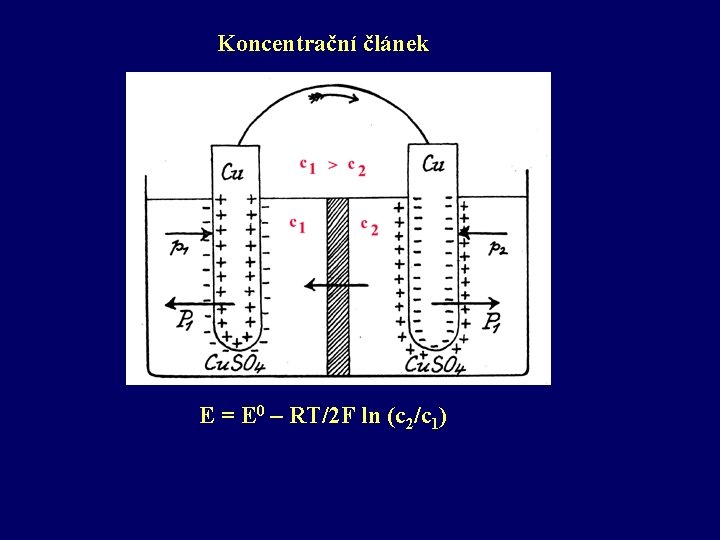
Koncentrační článek E = E 0 – RT/2 F ln (c 2/c 1)

Nernstovu rovnici můžeme použít pro výpočet potenciálu vznikajícího při redox reakcích v buňce. Reakci: reduktant + oxidant = oxidovaný reduktant + redukovaný oxidant si můžeme zjednodušit: donor elektronů = akceptor elektronů + elektron potom DE 0 = E 0(akceptoru) - E 0(donoru) jelikož DG 0 = - n. F DE 0 dostáváme: E = E 0 + RT/n. F ln( [akceptor]/[donor] )

Membránový potenciál

Pro výpočet membránového potenciálu budeme nejprve uvažovat, jaké množství energie je potřeba pro transport látky přes membránu. Pro transport 1 molu látky z oblasti o koncentraci c 1 do oblasti o koncentraci c 2 dostáváme: DG = RT ln (c 2/ c 1) Když c 2 je menší než c 1, DG je negativní a transport probíhá. Za rovnováhy je DG = 0, koncentrace se vyrovnají a transport se zastaví. Když máme iont o náboji Z, změna Gibbsovy energie při jeho transportu bude obsahovat dvě komponenty – koncentrační člen a člen popisující pohyb náboje: DG = RT ln (c 2/ c 1) + ZF Dy kde Dy je membránový potenciál ve voltech.