DETERMINACION DE LA FORMULA EMPIRICA Preparado por Licda






- Slides: 8

DETERMINACION DE LA FORMULA EMPIRICA Preparado por: Licda. Sheyla Acosta

FORMULA EMPÍRICA n La fórmula empírica es la forma mas simple de representar la proporción de los átomos o elementos de un compuesto, utilizando números enteros pequeños. n ¿Cómo podemos deducir la fórmula empírica? Se puede deducir si conocemos los porcentajes de los átomos que forman las moléculas

FORMULA EMPIRICA n Veamos un ejemplo Obténgase la formula empírica de un Hidrocarburo cuyo análisis dio la siguiente composición: C= 85. 63% H= 14. 37% Esto significa que en exactamente 100 gramos de este compuesto habrá 85. 63 g de C y 14. 37 g de H; lo que denota que la mayor parte de este hidrocarburo es C , y en una menor proporción se encuentra el H

FORMULA EMPÍRICA n Organicemos la C= 85. 63% H= 14. 37% información que nos proporcionan ELEMENTO MASA DEL ELEMENTO PESO ATOMOCO MASA DEL Carbono 85. 63 12. 011 Hidrogeno 14. 37 1. 00 ELEMENTO/PES O ATOMICO Esta información la encontramos en la tabla Periódica X (El elemento en cuestión )

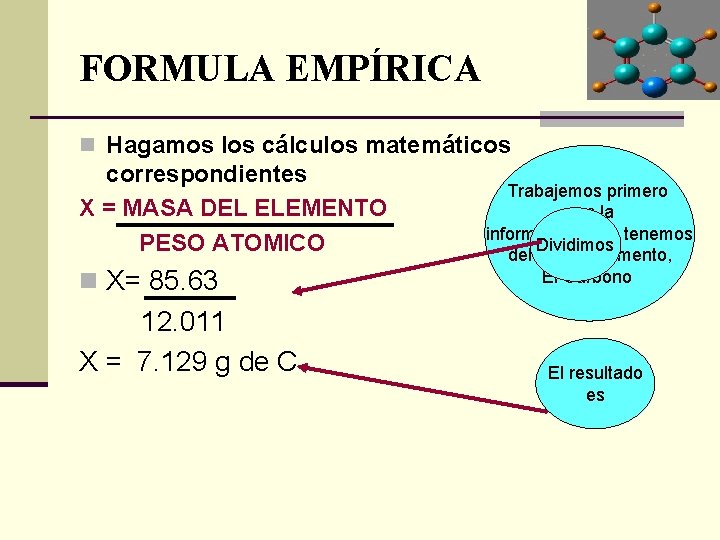
FORMULA EMPÍRICA n Hagamos los cálculos matemáticos correspondientes X = MASA DEL ELEMENTO PESO ATOMICO n X= 85. 63 12. 011 X = 7. 129 g de C Trabajemos primero con la información que tenemos Dividimos del primer elemento, El Carbono El resultado es

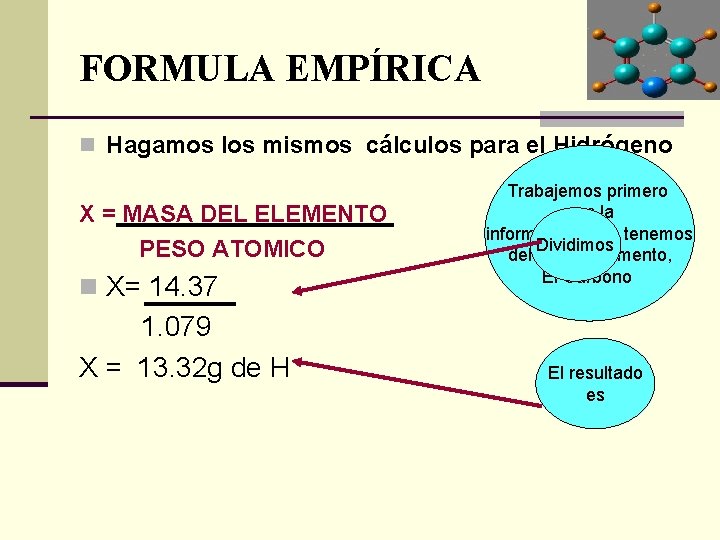
FORMULA EMPÍRICA n Hagamos los mismos cálculos para el Hidrógeno X = MASA DEL ELEMENTO PESO ATOMICO n X= 14. 37 1. 079 X = 13. 32 g de H Trabajemos primero con la información que tenemos Dividimos del primer elemento, El Carbono El resultado es

FORMULA EMPÍRICA n Después entre los valores encantarados para X se selecciona el resultado que tenga la cifra de menor proporción y se divide este para cada valor de X encontrado X = 7. 129 g de C X = 13. 32 g de H Valores de X encontrados Observe que el de menor valor es el elemento X que corresponde al Carbono , por lo tanto dividiremos ambos resultados entre ese menor valor. 7. 129/ 7. 129 = 1 átomo de Carbono 13. 32/ 7. 129 = 2 átomos de Hidrógeno

FORMULA EMPÍRICA n Completemos ahora nuestra tabla ELEMENTO MASA DEL ELEMENTO PESO ATOMOCO MASA DEL ELEMENTO/PESO ATOMICO X (El elemento en cuestión ) Carbono 85. 63 12. 011 7. 129 g de C 1 átomo de Carbono Hidrogeno 14. 37 1. 00 13. 32 g de H 2 átomos de Hidrógeno Ahora podemos Escribir la fórmula Empírica de nuestro hidrocarburo C 1 átomo , Hidrogeno 2 átomos CH 2