Department of Cancer Medicine Institut Gustave Roussy University






![Resultados: -Uso de bifosfonatos o denosumab similar en ambos grupos enzalutamide [26%] - placebo Resultados: -Uso de bifosfonatos o denosumab similar en ambos grupos enzalutamide [26%] - placebo](https://slidetodoc.com/presentation_image_h2/afef40067114b9315e52132214649d25/image-8.jpg)





- Slides: 21

Department of Cancer Medicine, Institut Gustave Roussy, University of Paris Sud, Villejuif, France (Y Loriot MD, Prof K Fizazi MD); Department of Urology, Charité— Universitätsmedizin Berlin, Germany (Prof K Miller MD); Department of Medical Oncology, San. Camillo and Forlanini Hospitals, Rome, Italy(Prof C N Sternberg MD); Drug Development Unit, Royal Marsden Hospital and Institute of Cancer Research, London, UK (Prof J S De Bono MD); Department of Urology, Guys and St Thomas’ Hospital, London, UK (S Chowdhury Ph. D); Department of Medicine, Division of Medical Oncology, University of Washington/Fred Hutchinson Cancer Research Center, Seattle, WA, USA(C S Higano MD); Department of Early Clinical Development (S Noonberg MD) and Department of Medical Aff airs (H Mansbach MD), Medivation, San Francisco, CA, USA; Health Economics and Outcomes Research, Astellas Pharma Europe, Leiden, Netherlands (S Holmstrom MSc); Astellas Pharma Global Development, Northbrook, IL, USA (F G Perabo MD, D Phung BSc); Consulting, Quintiles, Hoofddorp, Netherlands (C Ivanescu Ph. D); Consulting, Quintiles, Barcelona, Spain (K Skaltsa Ph. D); Department of Public Health, University of Barcelona, Spain (K Skaltsa); Division of Hematology and Medical Oncology, OHSU Knight Cancer Institute, Oregon Health & Science University, Portland, OR, USA (Prof T M Beer MD); and Department of Urology, Cliniques Universitaires Saint-Luc, Brussels, Belgium (Prof B Tombal MD)

Sobrevida libre de progresión radiológica a los 12 meses fue de 65% ptes con enzalutamida vs 14% pacientes con placebo. (reduccion del riesgo de 81% Hr 0. 19; 95% [CI], 0. 15 to 0. 23; P<0, 001. SG al momento del corte: 72% vs 63%. 29% de la reducción del riesgo de muerte. Fue significativamente beneficioso en todos los end points secundarios: tiempo hasta la utilización de qmt Tiempo hasta el evento oseo La mejor respuesta del tejido blando Tiempo hasta la progresión del PSA Caída del PSA < 50%

FDA Approval for Enzalutamide Brand name(s): Xtandi® Approved for metastatic castration-resistant prostate cancer following docetaxel therapy.

Introducción Cáncer de próstata resistente a castración asociado a pobre pronóstico, alta morbilidad, y expectativa de muerte de 1 -2 años. objetivo: - prevenir el deterioro de la Calidad de vida asociado progresión. - retrasar eventos esqueléticos. - retrasar la aparición del dolor.

Diseño del estudio -Multinacional -Fase III -Doble ciego. -Randomizado: 1: 1 enzalutamida 160 mg/dia vs placebo. -Pacientes sin qmt previa, >18 años, con ca de próstata metastásico resistente a castración. PS 0 o 1. sin dolor o leve -el estudio se suspendio al llegar a 540 muertes, supervivencia intermedia. - duracion del tratamiento: hasta evento adverso inaceptable progresión confirmada por imágenes evento esquelético (definido como Cx o RDT ósea por ca de próstata, fx patológica, compresión espinal, necesidad de cambio en el tratamiento antineoplásico) Los cambios en analgésicos para dolor óseo no se consideraron como evento esquelético. -Se permitió la coadministración de bifosfonatos u otra droga target ósea, y de corticoides.

End points: Calidad de vida y Dolor cambios con respecto a la basal % de mejoría tiempo de deterioro Eventos óseos proporción de eventos tiempo hasta el primer evento

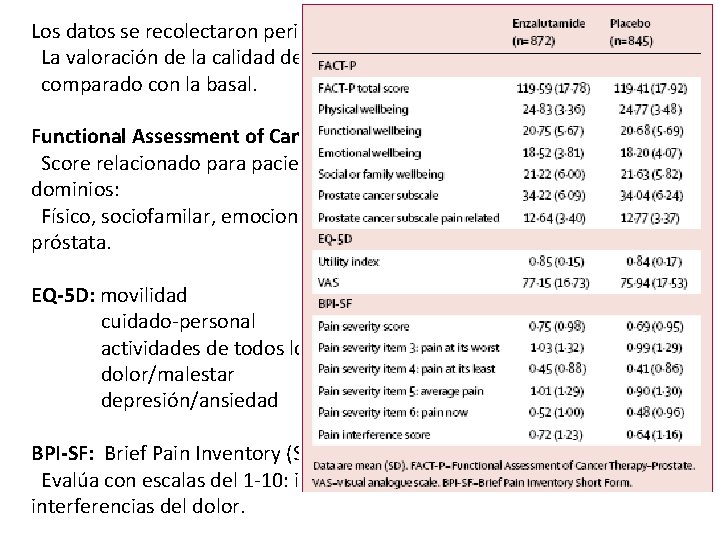
Los datos se recolectaron periódicamente en cuestionarios. La valoración de la calidad de vida, se baso en el incremento o deterioro comparado con la basal. Functional Assessment of Cancer Therapy-Prostate (FACT-P): Score relacionado para pacientes con ca de próstata. 27 items con 5 dominios: Físico, sociofamilar, emocional, funcional, y sintomas relacionados a la próstata. EQ-5 D: movilidad cuidado-personal actividades de todos los días dolor/malestar depresión/ansiedad BPI-SF: Brief Pain Inventory (Short Form) Evalúa con escalas del 1 -10: intensidad, alivio con tratamiento, interferencias del dolor.
![Resultados Uso de bifosfonatos o denosumab similar en ambos grupos enzalutamide 26 placebo Resultados: -Uso de bifosfonatos o denosumab similar en ambos grupos enzalutamide [26%] - placebo](https://slidetodoc.com/presentation_image_h2/afef40067114b9315e52132214649d25/image-8.jpg)
Resultados: -Uso de bifosfonatos o denosumab similar en ambos grupos enzalutamide [26%] - placebo [27%] -uso de corticoides: enzalutamide 27% - placebo 30% (pero el estudio no fue realizado para valorar eficacia de corticoides) -Duración del tratamiento enzalutamide vs placebo (16, 6 meses vs 4, 6 meses) HRQo. L=health-related quality of life. FACT-P=Functional Assessment of Cancer Therapy–Prostate. ITT=intention-to-treat. *Most discontinued because of rising prostatespecific antigen. †The EQ-5 D questionnaire was not scheduled for completion at the week 5 visit.

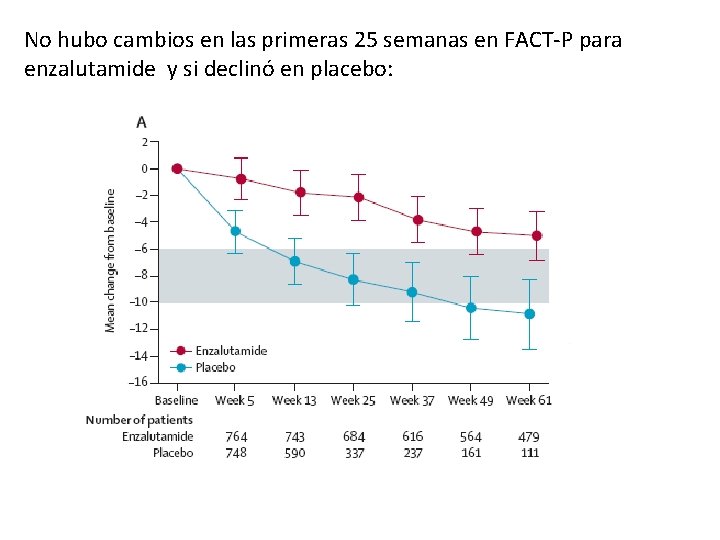
No hubo cambios en las primeras 25 semanas en FACT-P para enzalutamide y si declinó en placebo:

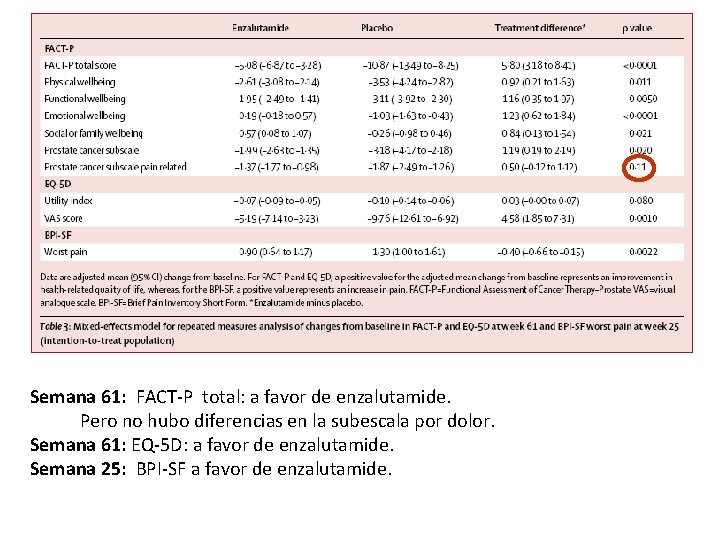
Semana 61: FACT-P total: a favor de enzalutamide. Pero no hubo diferencias en la subescala por dolor. Semana 61: EQ-5 D: a favor de enzalutamide. Semana 25: BPI-SF a favor de enzalutamide.

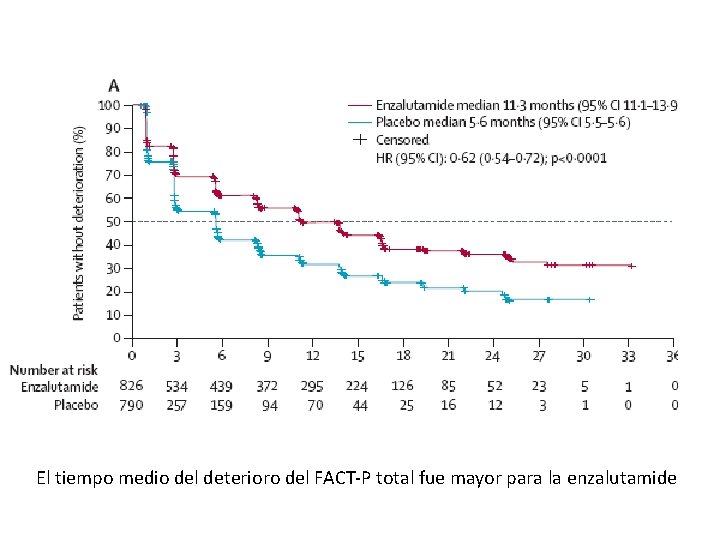
El tiempo medio del deterioro del FACT-P total fue mayor para la enzalutamide

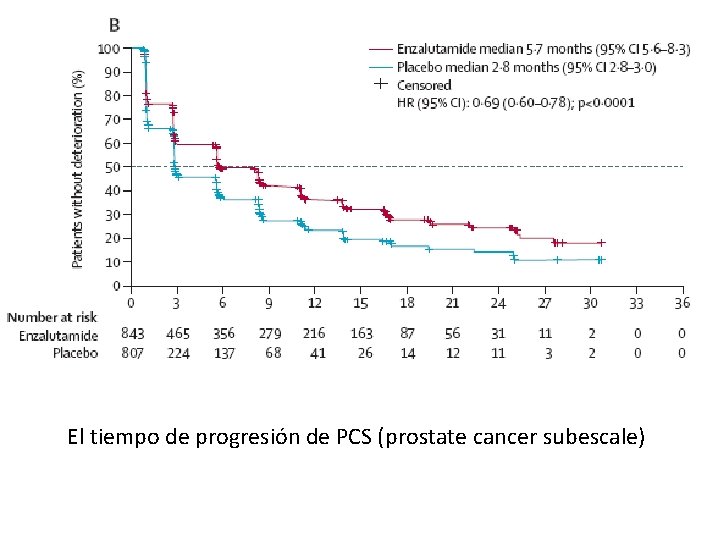
El tiempo de progresión de PCS (prostate cancer subescale)

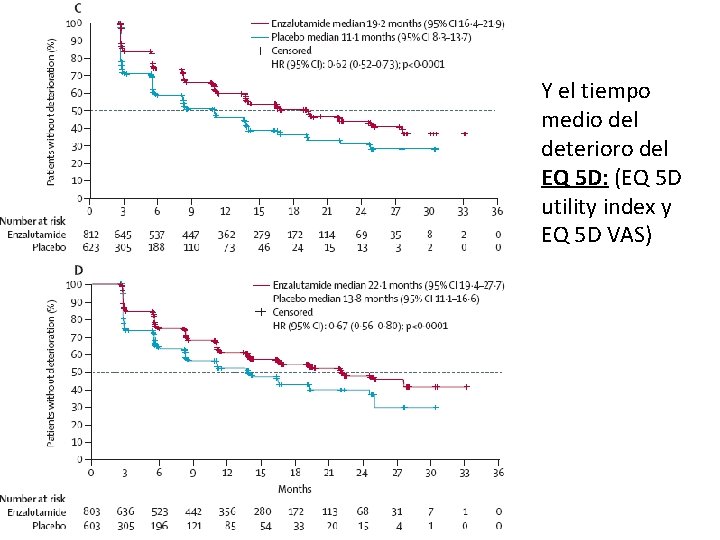
Y el tiempo medio del deterioro del EQ 5 D: (EQ 5 D utility index y EQ 5 D VAS)

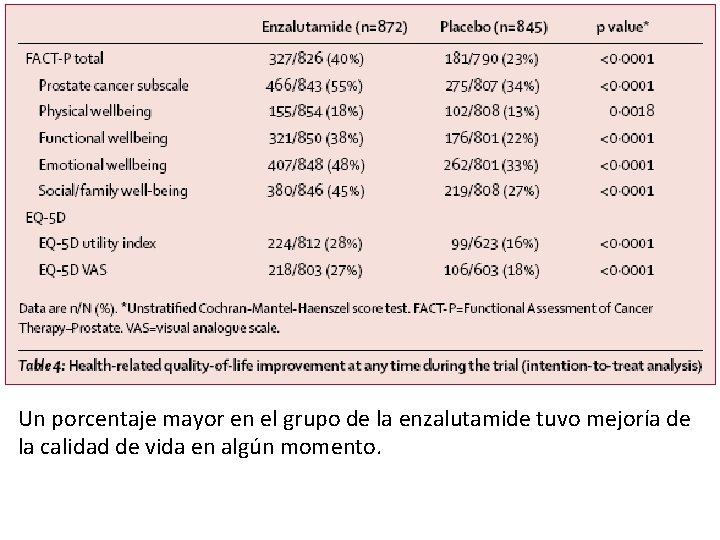
Un porcentaje mayor en el grupo de la enzalutamide tuvo mejoría de la calidad de vida en algún momento.

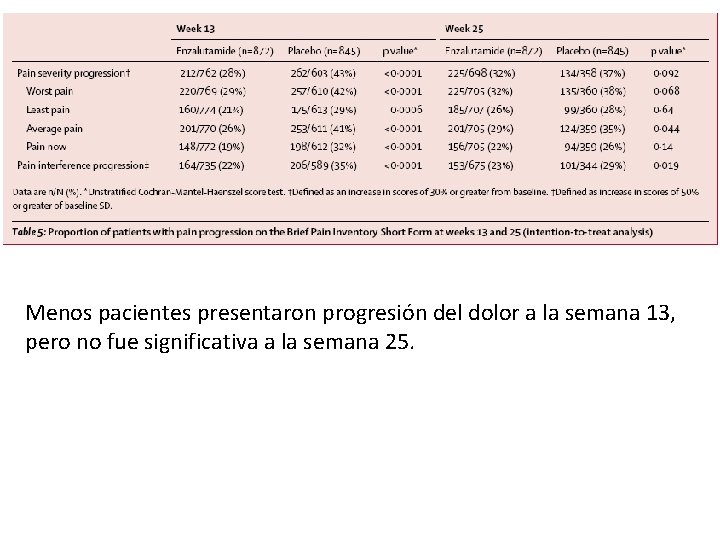
Menos pacientes presentaron progresión del dolor a la semana 13, pero no fue significativa a la semana 25.


Enzalutamida se asocia con retraso en el empeoramiento del dolor (BPI-SF) versus placebo (mediana de tiempo hasta la progresión 5. 7 meses [95% CI 5 · 6. 5 · 7] vs 5, 6 meses HR 0 · 62 [95% IC 0 · 53 -0 · 74]; p <0 · 0001), así como BPI-SF intensidad del dolor promedio y Interferencia con la vida.

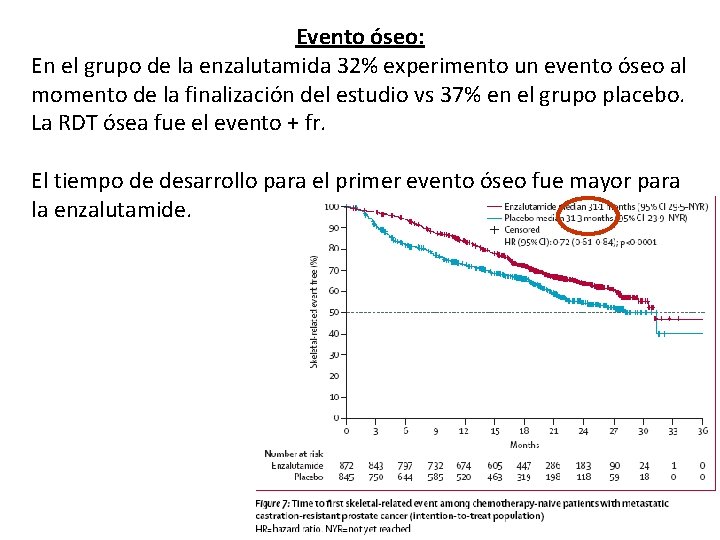
Evento óseo: En el grupo de la enzalutamida 32% experimento un evento óseo al momento de la finalización del estudio vs 37% en el grupo placebo. La RDT ósea fue el evento + fr. El tiempo de desarrollo para el primer evento óseo fue mayor para la enzalutamide.

Discusión *Enzalutamida comparado con placebo produce beneficio clínico significativo en calidad de vida, en ptes con ca de próstata metastásico resistentes a castración asintomáticos o mínimamente sintomáticos. *Aunque hubo beneficio en el manejo del dolor fue modesto. Principalmente por que se incluyo pacientes con baja carga tumoral y sintomática. *Los pacientes con enzalutamide tuvieron menor alteración en la calidad de vida a pesar de las reacciones adversas medicamentosas. *La reducción de eventos óseos con enzalutamide fue igual para pacientes con o sin bifosfonatos o denosumab. *No se realizo análisis del uso de opiodes.

Calidad de vida: Semana 61: FACT-P total: a favor de enzalutamide. Pero no hubo diferencias en la subescala por dolor. Semana 61: EQ-5 D: a favor de enzalutamide. Semana 25: FACT-P El tiempo medio del deterioro del FACT-P total fue mayor para la enzalutamide 11, 3 vs 5, 6 meses. El tiempo medio de deterioro de calidad de vida por EQ-5 D fue de 19, 2 vs 11, 1 Tiempo de progresión de síntomas prostáticos fue de 5, 7 vs 2, 8 meses Dolor: Menos pacientes presentaron progresión del dolor a la semana 13, pero no fue significativa a la semana 25. Tiempo de progresión del dolor 8, 3 vs 2, 8 meses FACT-P. pero por BPI SF aunque significativa la diferencia, fue escasa. 5, 7 vs 5, 6 meses. Eventos óseos: En el grupo de la enzalutamida 32% experimento un evento óseo al momento de la finalización del estudio vs 37% en el grupo placebo.

 Institut gustave roussy formation
Institut gustave roussy formation Umn vs lmn
Umn vs lmn Moreau zjevení
Moreau zjevení Gustave courbet realismus
Gustave courbet realismus Courbet millet
Courbet millet Moreau salome
Moreau salome Noel greenaway
Noel greenaway Bovarizam
Bovarizam Gustave eiffel opere
Gustave eiffel opere Gustave moreau zjevení
Gustave moreau zjevení Gustave courbet
Gustave courbet La chute de lucifer gustave doré
La chute de lucifer gustave doré Moreau zjevení
Moreau zjevení Turkish woman
Turkish woman Courbet kőtörők
Courbet kőtörők Gustave courbet self portrait
Gustave courbet self portrait ‘over land by rail’, gustave dore, 1870
‘over land by rail’, gustave dore, 1870 Gustave vichy
Gustave vichy Poetica di zola
Poetica di zola Kamieniarze gustave courbet
Kamieniarze gustave courbet Dante's inferno etchings
Dante's inferno etchings Department of medicine solna
Department of medicine solna






































