Corrig des exercices de Spcialit dernier Isolement du







- Slides: 9

Corrigé des exercices de Spécialité (dernier !) Isolement du salicylate de N° 6 p. 127 méthyle 1. Une estérification : acide carboxylique + alcool = ester +eau. 2. a. Il s’agit du catalyseur : il n’apparaît pas dans le bila Accélérer la réaction, afin d’atteindre plus 2. b. rapidement l’état final (qui est néanmoins À inchangé). 0°C (= eau glacée), le salicylate de méthyle est 3. liquide (PF -9°C et PÉ 222°C). Sa solubilité dans l’eau est assez faible (0, 7 g/L), il va donc former une phase organique qui va se décanter (densité 1, 18 supérieure à 1). On va donc utiliser une ampoule à décanter. 4. a. Densité 0, 66 pour l’hexane donc surnage.

Phase organique {hexane + salicylate de méthyle extrait} Phase aqueuse {eau glacée} Le PÉ du solvant (68°C) 4. b. est plus faible que celui du salicylate de méthyle (222°C), on peut donc éliminer le solvant par évaporation : une distillation. Pour cela on utilise l’évaporateur rotatif (ci-contre) ou même un montage de

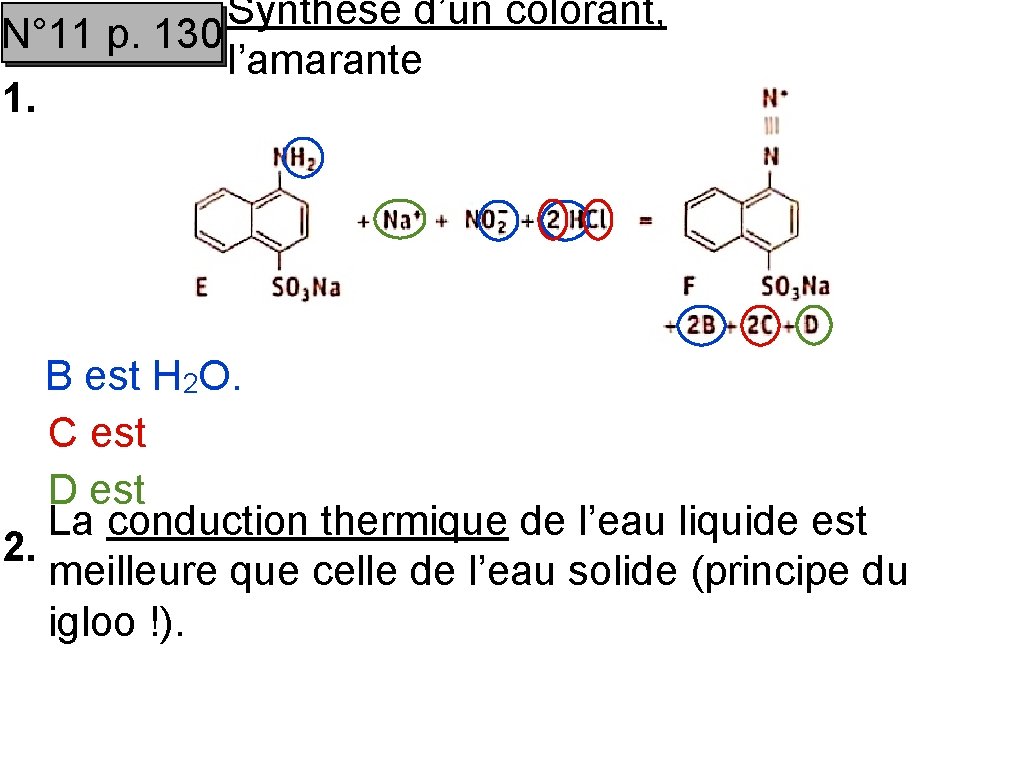
Synthèse d’un colorant, N° 11 p. 130 l’amarante 1. B est H 2 O. C est D est La conduction thermique de l’eau liquide est 2. meilleure que celle de l’eau solide (principe du igloo !).

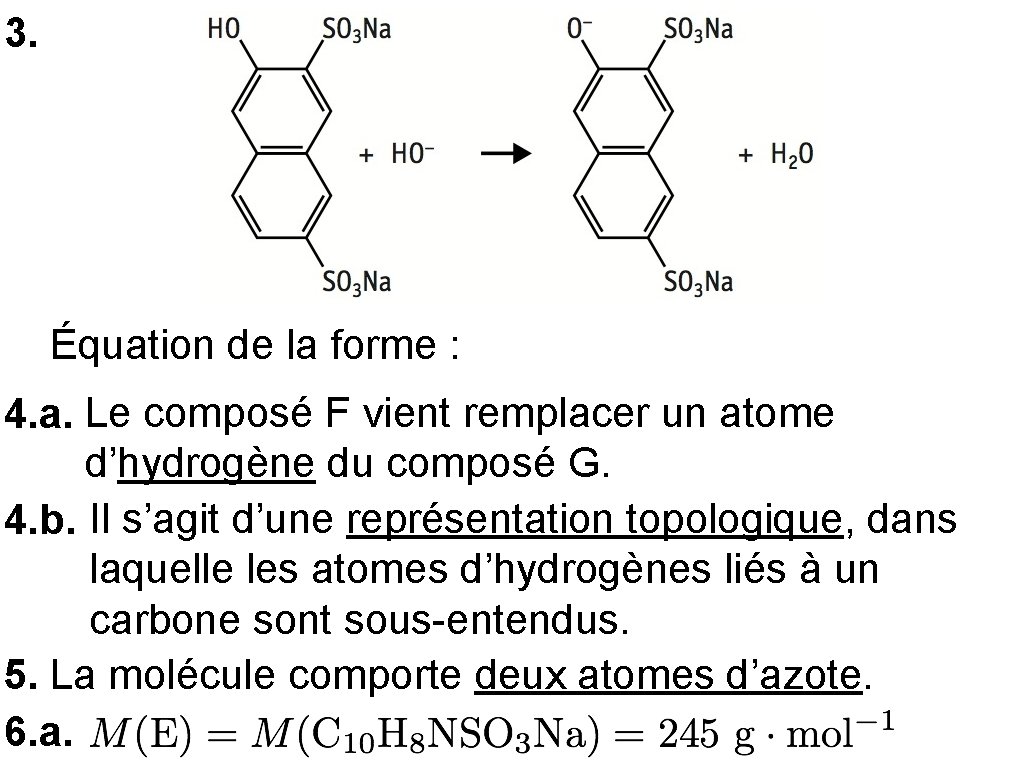
3. Équation de la forme : 4. a. Le composé F vient remplacer un atome d’hydrogène du composé G. 4. b. Il s’agit d’une représentation topologique, dans laquelle les atomes d’hydrogènes liés à un carbone sont sous-entendus. 5. La molécule comporte deux atomes d’azote. 6. a.

Les cœfficients stœchiométriques valent tous un, le réactif limitant est le nitrite de sodium. 6. b. La réaction se fait mole à mole, donc une quantité maximale pour F de 10, 1 mmol. 7. a. Quantité de F disponible pour l’étape 2 : Quantité de G disponible pour l’étape 2 : provient de l’équation A/B écrite à la question 3.

Donc 8, 62 mmol de G, l’équation A/B du 3 s’effectuant mole à mole. Par suite, l’étape 2 s’effectuant mole à mole, F est le réactif limitant. 7. b. Il peut se former 8, 1 mmol d’amarante ;

8. Seule la bixine (molécule a)) présente une longue alternance de liaisons doubles séparées par une seule liaison simple, et est donc colorée. Synthèse d’un colorant, N° 12 p. 130 l’amarante 1. 2. H 3. Lente, équilibrée, athermique. 4. a. Les protons apportés par l’acide sulfurique servent de catalyseur. 4. b. Chauffer pour accélérer ; À reflux pour éviter toute perte de matière. Déplacement d’équilibre (excès du réactif le 4. c. couteux)

5. a. L’ion carbonate est une base : il permet de neutraliser l’acidité du milieu réactionnel. L’ajout de la solution de carbonate de sodium 5. b. permet d’atteindre p. H=9 ; donc p. H > p. Ka+1=4, 9+1=5, 9 donc l’espèce prédominante du couple HA/A est la base A. 5. c. Na. A est très soluble dans l’eau (cf données), donc A- est en phase aqueuse. 5. d. Phase organique (éthoxyéthane ou éther) Phase aqueuse

5. e. Désséchant : élimine les dernières traces d’eau de la phase organique. 6. Le solide synthétisé n’est pas pur puisque son chromatogramme présente deux tâches : on constate qu’il reste un peu d’acide HA. ★