Captulo 20 A segunda lei da termodinmica Fsica












- Slides: 15

Capítulo 20 A segunda lei da termodinâmica Física II – Termondinâmica e Ondas Sears | Zemansky | Young | Freedman © 2008 by Pearson Education slide 1

Física II – Termondinâmica e Ondas Sears | Zemansky | Young | Freedman © 2008 by Pearson Education slide 2

Física II – Termondinâmica e Ondas Sears | Zemansky | Young | Freedman © 2008 by Pearson Education slide 3

Máquinas Térmicas (1ª Forma) “Não é possível realizar uma série de processos cujo único resultado seja a transferência de energia na forma de calor de um reservatório térmico e sua completa conversão em trabalho”. eficiência Física II – Termondinâmica e Ondas Sears | Zemansky | Young | Freedman © 2008 by Pearson Education slide 4

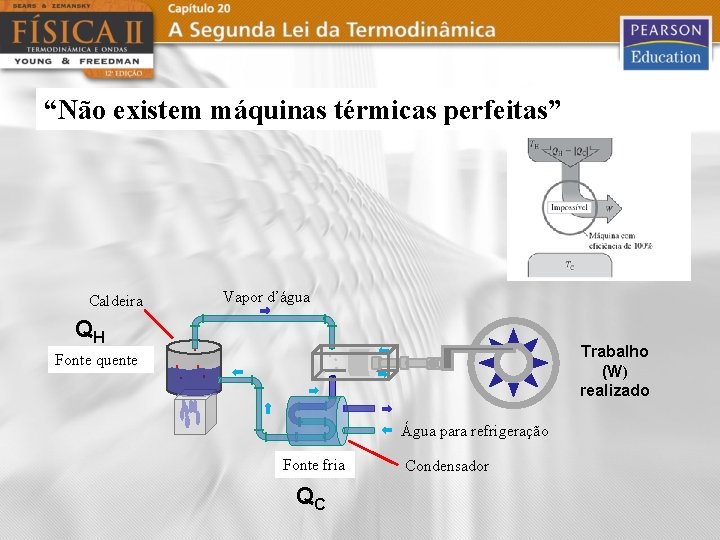
“Não existem máquinas térmicas perfeitas” Caldeira Vapor d’água QH Trabalho (W) realizado Fonte quente Água para refrigeração Fonte fria QC Condensador

Refrigeradores (2ª Forma) “Não é possível uma série de processos cujo único efeito seja a transferência de energia na forma de calor de um reservatório a uma dada temperatura para um reservatório a uma temperatura mais alta”. Coeficiente de performance Física II – Termondinâmica e Ondas Sears | Zemansky | Young | Freedman © 2008 by Pearson Education slide 6

A irreversibilidade se dá em processos espontâneos, porém, com gasto de energia, é possível fazer processos ocorrerem de modo inverso ao que ocorreria espontaneamente. Como exemplo, temos a geladeira, uma máquina que retira calor de seu interior (fonte fria) e despeja numa fonte quente através de um trabalho executado por um compressor. Fonte Quente Assim, num refrigerador temos que: Trabalho (W) “Não existe m refrigeradores perfeitos” Refrigerador Fonte Fria slide 7

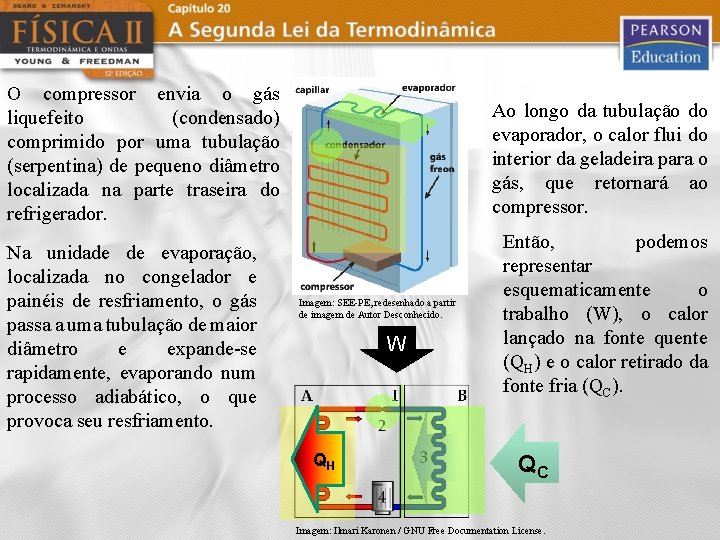
O compressor envia o gás liquefeito (condensado) comprimido por uma tubulação (serpentina) de pequeno diâmetro localizada na parte traseira do refrigerador. Na unidade de evaporação, localizada no congelador e painéis de resfriamento, o gás passa a uma tubulação de maior diâmetro e expande-se rapidamente, evaporando num processo adiabático, o que provoca seu resfriamento. Ao longo da tubulação do evaporador, o calor flui do interior da geladeira para o gás, que retornará ao compressor. Imagem: SEE-PE, redesenhado a partir de imagem de Autor Desconhecido. W QH Então, podemos representar esquematicamente o trabalho (W), o calor lançado na fonte quente (QH) e o calor retirado da fonte fria (QC). QC Imagem: Ilmari Karonen / GNU Free Documentation License.

Entropia - S A mudança no contexto onde uma energia é dispersada, de uma maneira desordenada, depende da quantidade de energia transferida sob a forma de calor. Moléculas em um sistema a alta temperatura: altamente desorganizados (localização e estados de energia) Moléculas em um sistema a baixa temperatura: possuem estados de energias mais baixos. Fornecendo-se a mesma quantidade de calor aos dois sistemas, resultará em uma adição relativamente pequena na desordem do primeiro e maior efeito na desordem do segundo sistema. slide 9

Ao percorrer um ciclo reversível completo, a soma algébrica da entropia é nula. A variação S pra um sistema que sofre uma mudança reversível de um estado inicial para um estado final é definida por: Unidade SI: J/K

Processo Isotérmico

2ª Lei da Termodinâmica (3ª Forma) “Em qualquer processo termodinâmico que vai de um estado de equilíbrio para outro , a entropia do conjunto sistema + ambiente aumenta ou permanece constante”

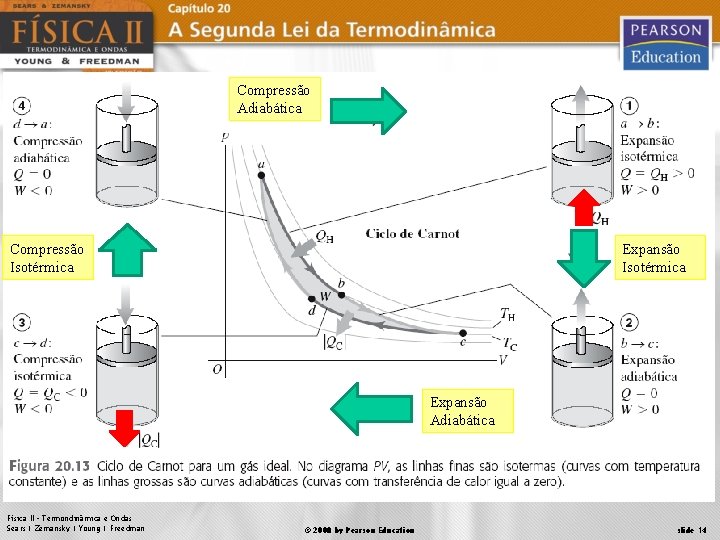
O Ciclo de Carnot Dada uma fonte quente e uma fonte fria, qual o máximo rendimento que se pode obter de uma máquina operando entre estas duas fontes O processo precisa ser reversível (não há atrito e é realizado lentamente, podendo ser revertido em qualquer estágio) 4 estágios: 2 processos isotérmicos e 2 processos adiabáticos. Física II – Termondinâmica e Ondas Sears | Zemansky | Young | Freedman © 2008 by Pearson Education slide 13

Compressão Adiabática Compressão Isotérmica Expansão Adiabática Física II – Termondinâmica e Ondas Sears | Zemansky | Young | Freedman © 2008 by Pearson Education slide 14

“Nenhuma máquina real, operando entre duas temperaturas pode ter uma eficiência maior do que uma máquina de Carnot operando entre as mesmas temperaturas” Eficiência da máquina de Carnot Se for operado de modo inverso, como um refrigerador, seu coeficiente de performance será: Física II – Termondinâmica e Ondas Sears | Zemansky | Young | Freedman © 2008 by Pearson Education slide 15
 Https://slidetodoc.com/captulo-2-o-sudeste-e-o-sul-do/
Https://slidetodoc.com/captulo-2-o-sudeste-e-o-sul-do/ Https://slidetodoc.com/captulo-2-o-sudeste-e-o-sul-do/
Https://slidetodoc.com/captulo-2-o-sudeste-e-o-sul-do/ Lei de ohm
Lei de ohm Expansão adiabática
Expansão adiabática Segunda lei de newton
Segunda lei de newton Segunda lei de gossen
Segunda lei de gossen Força resultante
Força resultante Um casal ambos polidáctilos e de visão normal
Um casal ambos polidáctilos e de visão normal 2 lei de ohn
2 lei de ohn Segunda lei de mendel
Segunda lei de mendel Segunda lei da termodinamica enunciado
Segunda lei da termodinamica enunciado Segunda lei de ohm
Segunda lei de ohm Inercia
Inercia Lei de coulomb e lei da gravitação universal
Lei de coulomb e lei da gravitação universal Termodinmica
Termodinmica Trabajo adiabatico
Trabajo adiabatico