14 CLASE DE QUMICA IDENTIFICAR RECONOCER Y DETERMINAR










- Slides: 13

14° CLASE DE QUÍMICA IDENTIFICAR , RECONOCER Y DETERMINAR LO QUE ES LA MASA MOLAR. IDENTIFICAR, RECONOCER Y DETERMINAR LO QUE ES EL MOL. IDENTIFICAR , RECONOCER Y DETERMINAR LO QUE ES CONCENTRACIÓN MOLAR

LAS MOLÉCULAS Y LOS COMPUESTOS QUÍMICOS SE REPRESENTAN MEDIANTE FÓRMULAS QUÍMICAS, LAS FÓRMULAS QUÍMICAS ESTÁN FORMADAS POR LOS SÍMBOLOS DE LOS ELEMENTOS QUE LA FORMAN FÓRMULA DE ÁCIDO SULFÚRICO Pedro Armijo el coeficiente estequiométrico (el n° de adelante) nos indica la cantidad de moléculas Los subíndices Son los números que indican el número de átomos que participa en el compuesto. OJO EL 1 NO SE COLOCA 2

1. - Ca. Br 2 BROMURO DE CALCIO ¿CUANTOS ÁTOMOS DE Ca HAY EN LA FÓRMULA? 1 ¿CUANTOS ÁTOMOS DE Fe HAY EN LA FÓRMULA? 2 ¿CUANTOS ÁTOMOS DE S HAY EN LA FÓRMULA? 3 Pedro Armijo ¿CUANTOS ÁTOMOS DE Br HAY EN LA FÓRMULA? 3. - Fe 2 S 3 SULFURO FÉRRICO 2 2. - Zn. S SULFURO DE ZINC ¿CUANTOS ÁTOMOS DE Zn HAY EN LA FÓRMULA? 1 3

4 Pedro Armijo La masa de una molécula se conoce como Masa Molar, se abrevia como (M) y se expresa en gr/mol. Se obtiene sumando las masas atómicas de los elementos

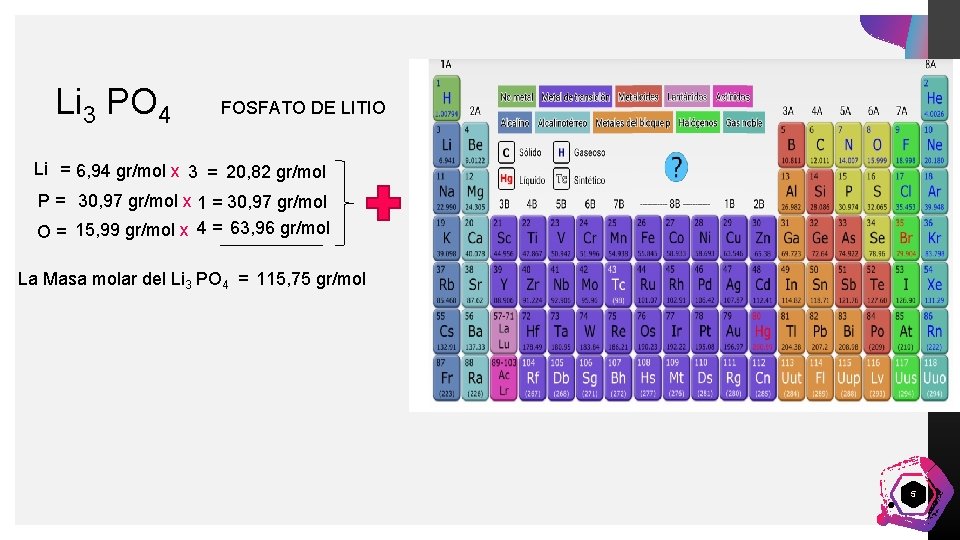
Li 3 PO 4 FOSFATO DE LITIO Li = 6, 94 gr/mol x 3 = 20, 82 gr/mol Pedro Armijo P = 30, 97 gr/mol x 1 = 30, 97 gr/mol O = 15, 99 gr/mol x 4 = 63, 96 gr/mol La Masa molar del Li 3 PO 4 = 115, 75 gr/mol 5

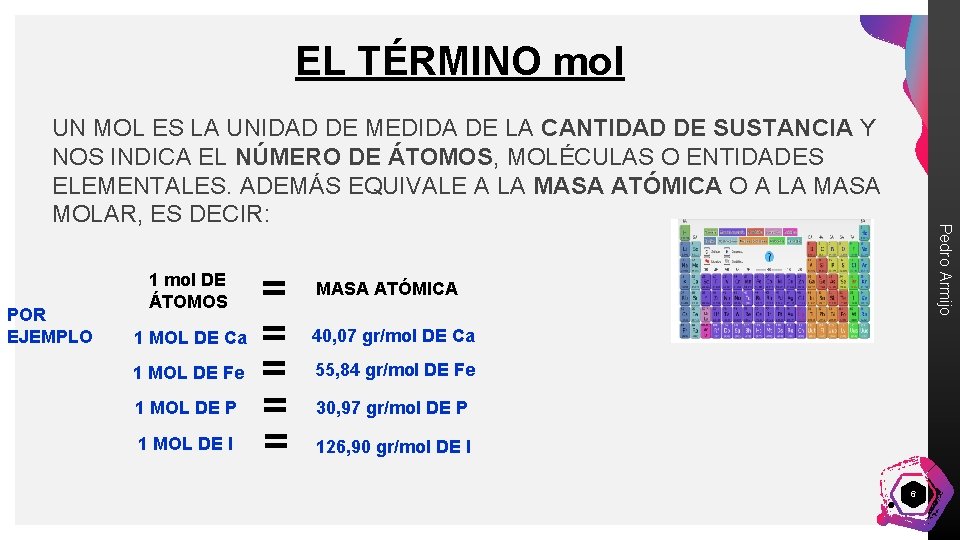
EL TÉRMINO mol POR EJEMPLO 1 mol DE ÁTOMOS 1 MOL DE Ca 1 MOL DE Fe 1 MOL DE P 1 MOL DE I = = = Pedro Armijo UN MOL ES LA UNIDAD DE MEDIDA DE LA CANTIDAD DE SUSTANCIA Y NOS INDICA EL NÚMERO DE ÁTOMOS, MOLÉCULAS O ENTIDADES ELEMENTALES. ADEMÁS EQUIVALE A LA MASA ATÓMICA O A LA MASA MOLAR, ES DECIR: MASA ATÓMICA 40, 07 gr/mol DE Ca 55, 84 gr/mol DE Fe 30, 97 gr/mol DE P 126, 90 gr/mol DE I 6

EL TÉRMINO mol 1 mol DE MOLÉCULAS POR EJEMPLO 1 MOL DE CO 1 MOL DE Na. Cl 1 MOL DE H 2 SO 4 = MASA MOLAR = 28 gr/mol DE CO = 58, 44 gr/mol DE Na. Cl = 98, 02 gr/mol DE H SO 2 Pedro Armijo UN MOL ES LA UNIDAD DE MEDIDA DE LA CANTIDAD DE SUSTANCIA Y NOS INDICA EL NÚMERO DE ÁTOMOS, MOLÉCULAS O ENTIDADES ELEMENTALES. ADEMÁS EQUIVALE A LA MASA ATÓMICA O A LA MASA MOLAR DE UNA MOLÉCULA, ES DECIR: 4 POR ESTA RAZÓN TANTO LA MASA ATÓMICA COMO LA MASA MOLAR SE ESCRIBEN EN gr/mol PORQUE CORRESPONDEN A LA CANTIDAD DE gr QUE SE ENCUENTRAN EN 1 mol 7

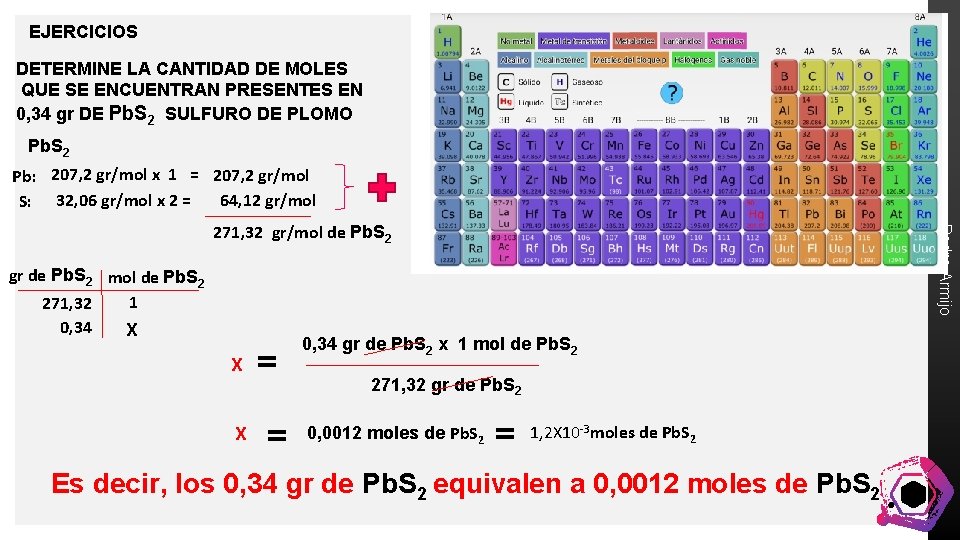
EJERCICIOS DETERMINE LA CANTIDAD DE MOLES QUE SE ENCUENTRAN PRESENTES EN 0, 34 gr DE Pb. S 2 SULFURO DE PLOMO Pb. S 2 Pb: 207, 2 gr/mol x 1 = 207, 2 gr/mol 64, 12 gr/mol S: 32, 06 gr/mol x 2 = gr de Pb. S 2 mol de Pb. S 2 1 271, 32 0, 34 X X X = = Pedro Armijo 271, 32 gr/mol de Pb. S 2 0, 34 gr de Pb. S 2 x 1 mol de Pb. S 2 271, 32 gr de Pb. S 2 0, 0012 moles de Pb. S 2 = 1, 2 X 10 -3 moles de Pb. S 2 Es decir, los 0, 34 gr de Pb. S 2 equivalen a 0, 0012 moles de Pb. S 2

MOLARIDAD O CONCENTRACIÓN MOLAR X moles DE SOLUTO Pedro Armijo CANTIDAD DE moles (n) DE SOLUTO QUE HAY EN 1 L(litro) DE DISOLUCION. 1 L DE DISOLUCIÓN 9

Se tiene una disolución de 2, 46 litros que se prepara con 4 moles de hidróxido de sodio (Na. OH). Cuál es la Molaridad de la disolución? X L de disolución 2, 46 1 X= 1 L de disolución x 4 moles de Na. OH 2, 46 L de disolución Pedro Armijo moles de Na. OH 4 X 1, 62 moles de Na. OH Debido a que los 1, 62 moles de Na. OH se encuentran en 1 L se puede escribir como: X 1, 62 Molar de Na. OH = 10

Determine la Concentración molar, ( la cantidad de soluto, en moles, que hay en un litro de la disolución)de 0, 64 L de disolución que contiene 20 gr de Sulfato de Cobre(Cu. SO 4) Masa molar Cu. SO 4 + O: 15, 99, 06 gr/mol x 4 = 63, 96 gr/mol 159, 56 gr/mol de Cu. SO 4 gr de Cu. SO 4 mol de Cu. SO 4 159, 56 20 1 X 20 gr de Cu. SO 4 x 1 mol de Cu. SO 4 X 159, 56 gr de Cu. SO 4 = X= 0, 12 mol de Cu. SO 4 0, 12 X L de disolución 0, 64 1 1 L de disolución x 0, 12 mol de X Cu. SO 4 0, 64 L de disolución = X 0, 18 mol de Cu. SO 4 = Debido a que los 0, 18 moles de Cu. SO 4 se encuentran en 1 L se puede escribir como: X= 0, 18 Molar de Cu. SO 4 Pedro Armijo Cu: 63, 54 gr/mol x 1 = 63, 54 gr/mol S: 32, 06 gr/mol x 1 = 32, 06 gr/mol

ESO ES TODO POR HOY Pedro Armijo 12

LA TAREA ESTARÁ EN CLASSROOM Pedro Armijo 13
 Identificar y reconocer
Identificar y reconocer Reconocer e identificar
Reconocer e identificar Un poema
Un poema Ser feliz es no tener miedo de los propios sentimientos
Ser feliz es no tener miedo de los propios sentimientos Como reconocer los puntos cardinales
Como reconocer los puntos cardinales Puntos cardinales para niños
Puntos cardinales para niños Capacidad de reconocer nuestros propios sentimientos
Capacidad de reconocer nuestros propios sentimientos Reconocer palabras
Reconocer palabras Verbal y no verbal
Verbal y no verbal Es facil reconocer a las mujeres fuertes
Es facil reconocer a las mujeres fuertes Objetivo de las fracciones
Objetivo de las fracciones Como reconocer la verdadera iglesia de cristo
Como reconocer la verdadera iglesia de cristo 20 sustantivos común
20 sustantivos común Determinar si dos planos son paralelos
Determinar si dos planos son paralelos