TEMAT LEKCJI STENIE PROCENTOWE Z tej lekcji dowiesz















- Slides: 16

TEMAT LEKCJI: „STĘŻENIE PROCENTOWE” Z tej lekcji dowiesz się: Co to jest stężenie procentowe Jak obliczać stężenie procentowe roztworu

Stężenie procentowe określa ile części masowych (wagowych) rozpuszczonej substancji znajduje się w 100 częściach masowych (wagowych) roztworu Zapis np. 5% oznacza, że w 100 gramach roztworu znajduje się 5 gramów substancji rozpuszczonej.

Stężenie procentowe można obliczyć, korzystając z wzoru: Cp= ms⋅100 %/mr gdzie: Cp– stężenie procentowe ms – masę substancji mr– masę roztworu UWAGA! Masa roztworu = masa rozpuszczalnika (np. wody) + masa substancji. Mr = mr-ka+ ms

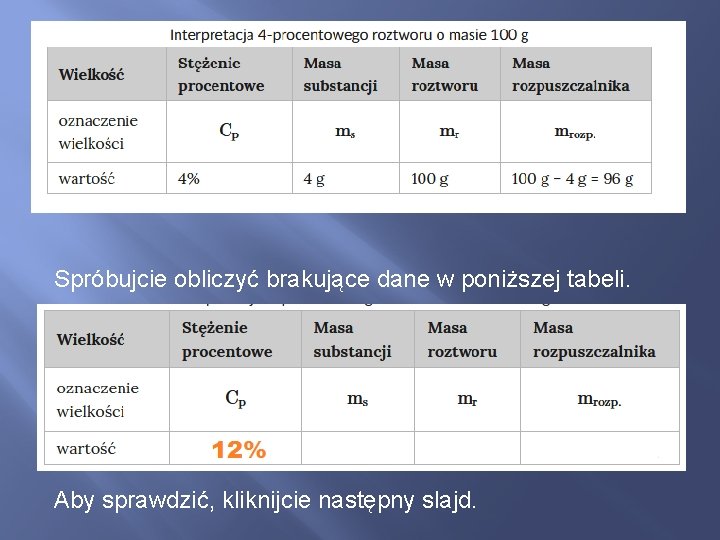
Spróbujcie obliczyć brakujące dane w poniższej tabeli. Aby sprawdzić, kliknijcie następny slajd.

Mam nadzieję, że Wam się udało obliczyć Przejdźmy do zadań

Zadanie 1. Oblicz stężenie procentowe roztworu cukru, jeśli 250 g roztworu zawiera 100 g tej substancji. Wypiszmy dane i szukane. Dane: Szukane: Mr = 250 g Cp=? Ms = 100 g a) Możemy wykorzystać wzór Cp=ms x 100%/mr Cp= 100 g x 100% / 250 g Cp= 40% Lub b) Wykorzystać proporcję: 100 g substancji – 250 g roztworu X - 100 g roztworu ( bo stężenie procentowe, określa ile substancji jest X = 100 g x 110 g / 250 g w 100 g roztworu) X =40 g Stężenie wynosi więc 40%

Zadanie 2. Oblicz stężenie procentowe roztworu chlorku sodu, który powstał po rozpuszczeniu 10 g tej substancji w 250 g wody. Wynik podaj z dokładnością do drugiego miejsca po przecinku. Obliczamy masę roztworu: 250 g wody + 10 g substancji = 260 g roztworu Dalszą część zadania możemy również rozwiązać na dwa sposoby. Odpowiedz: otrzymano roztwór o stężeniu 3, 85%.

Przy innych obliczeniach można korzystać zarówno z odpowiedniej proporcji, jak i z odpowiednio przekształconego wzoru na stężenie procentowe.

Zadanie 3. Oblicz, ile siarczanu(VI) miedzi(II) znajduje się w 250 g wodnego roztworu tej substancji o stężeniu 2%. Dane: Cp= 2% Mr = 250 g Szukane: ms=? Odpowiedź: Masa siarczanu(VI) miedzi(II) w 250 g roztworu o stężeniu 2% wynosi 5 g.

Zadanie 4. Oblicz masę wodnego roztworu chlorku potasu o stężeniu 1%, w którym znajduje się 1, 5 g tej substancji. Podaj masę wody, która znajduje się w tym roztworze. Dane: Cp= 1% Ms=1, 5 g Szukane: mr=? Z proporcji: 1 g – 100 g 1, 5 g – X X = 150 g roztworu – 1, 5 g substancji = 148, 5 g wody Odpowiedź: Masa roztworu wynosi 150 g, natomiast masa wody 148, 5 g.

Wykorzystując wzór: Mr= ms x 100%/ Cp Mr = 1, 5 g x 100%/ 1% Mr = 150 g roztworu – 1, 5 g substancji = 148, 5 g wody Odpowiedź: Masa roztworu wynosi 150 g, natomiast masa wody 148, 5 g.

Zadanie 5. Na podstawie wykresu rozpuszczalności substancji ( str. 178 w podręczniku), oblicz stężenie procentowe nasyconego roztworu azotanu(V) potasu KNO 3 w temperaturze 70 o. C. Odczytajcie z wykresu ile KNO 3 trzeba rozpuścić w temp. 70 o. C aby otrzymać roztwór nasycony ( to będzie nasza masa substancji). Spróbujcie następnie wykonać to zadanie samodzielnie.

Dane: Ms=140 g Szukane: Cp=? Mr = 140 g + 100 g wody Mr = 240 g Z proporcji: 240 g roztworu – 140 g substancji 100 g – X X = 100 g x 140 g / 240 g X = 58, 3 g czyli stężenie wynosi 58, 3% Ze wzoru: Cp = 140 g x 100 g / 240 g Cp = 58, 3% Odpowiedź: Stężenie procentowe wyniesie 58, 3%.

Zadanie ostatnie – najtrudniejsze Oblicz, ile gramów wodorotlenku sodu Na. OH potrzeba do przygotowania 500 cm 3 10% roztworu o gęstości 1, 115 g/cm 3. Wypisujemy: Dane: V= 500 cm 3 d=1, 115 g/cm 3 Cp= 10% Szukane: ms=? Pamiętacie wzór na gęstość? Przypominam: d=m/v Musimy go teraz wykorzystać, po przekształceniu: m= d x V m= 1, 115 g/cm 3 x 500 cm 3 m = 557, 5 g to jest nasza masa roztworu

A teraz korzystamy ze wzoru: Ms= Cp x mr / 100% Ms = 10% x 557, 5 g/100% Ms = 55, 75 g lub z proporcji: 10 g substancji – 100 g roztworu X – 557, 5 g X = 10 g x 557, 5 g / 100 g X= 55, 75 g Odpowiedź: należy użyć 55, 7 g wodorotlenku sodu.

Zadanie domowe: � � � Zapisać temat lekcji: „Stężenie procentowe” i zapisać wzór i definicję w zeszycie. Zapoznać się dokładnie z tą prezentacją i wykonać zdania 1, 2, 3, 4 str. 191 w podręczniku. Zadania proszę mi odesłać, są na ocenę W razie, pytań problemów, proszę pisać. Za tydzień podam link do sprawdzianu. Miłego dnia
 Ty jesteś bogiem wiernym na wieczny czas
Ty jesteś bogiem wiernym na wieczny czas Struktura administracji publicznej w polsce
Struktura administracji publicznej w polsce Rodzina wyrazow dom
Rodzina wyrazow dom Typy liryki
Typy liryki Funkcje łodygi
Funkcje łodygi Izydorczyk bernadetta
Izydorczyk bernadetta Boisko do pilki noznej
Boisko do pilki noznej Esej na temat
Esej na temat Kardynał stefan wyszyński ciekawostki
Kardynał stefan wyszyński ciekawostki Esej na temat
Esej na temat Choroby wskaznikowe aids
Choroby wskaznikowe aids Ile procent z liczby stanowi liczba
Ile procent z liczby stanowi liczba Setna część pewnej całości
Setna część pewnej całości Procentowe ryzyko zakażenia hiv
Procentowe ryzyko zakażenia hiv Tabela rozpuszczalności
Tabela rozpuszczalności Seks oralny a hiv
Seks oralny a hiv Wzór na stężenie procentowe
Wzór na stężenie procentowe