Stratgie gntique de contrle des maladies infectieuses chez
























- Slides: 26

Stratégie génétique de contrôle des maladies infectieuses chez le bétail Merlin Louis Simon Lionel Vanwynsberghe Thomas

Introduction Résistance aux maladies : défi majeur de génétique animale A long terme : secteur et industrie du bétail Étude concernant l’impact des gènes de résistance sur les maladies sporadiques par transmission directe d’animal à animal Ex : gène Pr. P qui contrôle la résistance du mouton à la scrapie Distinguer tolérance de résistance Résistance : capacité à résister à l’infection, à modérer le développement du parasite => elle diminue significativement la transmission Tolérance : capacité à résister aux effets pathogènes de la maladie => ne diminue pas la transmission

Propagation des épidémies : Intérêt des gènes conférant une résistance Toute la population ne doit pas être concernée pour éliminer un risque d’épidémie

R 0 : nombre d’infections secondaires causées par l’introduction d’un seul sujet infecté dans une population Si R 0 > 1 risque majeur d’épidémie Si R 0 ≤ 1 pas d’épidémie attendue ou épidémie mineure But : stratégie de contrôle des pathologies : réduire le R 0 en dessous de 1 dans la population Comment ? Sélectionner les animaux pour augmenter la résistance Mélanger les animaux génétiquement résistants avec les animaux sensibles de type sauvage

Modèle des 2 génotypes R 0 dans l’ensemble de la population : R 0 = ( R 01ρ1+R 02(1 -ρ1)) R 01 = transmission dans un groupe « sauvage » R 02 = transmission dans un groupe « résistant » ρ1 = proportion d’animaux « sauvages » dans le groupe Nb : ce modèle peut s’étendre à plus de 2 génotypes

3 cas possibles dans ce modèle Ø R 01<1 => pas de problème de maladies Ø R 02>1 => risque majeur d’épidémie quelque soit le génotype Ø R 01>1 et R 02<1 il faut diminuer ρ1 ( =le nombre d’animaux sensibles) de manière à ce que R 0<1 et donc qu’il n’y ait plus de risque majeur d’épidémie Calcul d’un ρ1 max pour obtenir un R 0<1 : ρ1=(R 0 -R 02)/(R 01 -R 02)

Probabilité d’épidémie Cependant, une épidémie mineure est quand même possible si R 0<1 tout comme une épidémie majeure n’est pas systématique si R 0>1 Ces cas peuvent être décrit grâce au modèle SIR : une pop de N animaux est constituée de S susceptibles, I infectés et R guéris avec β = taux de transmission et γ = taux de guérison

Ø Ø Ø Ø On peut obtenir l’évolution dans ces différentes populations grâce à: d. S/dt = -βSI d. I/dt = βSI – γI d. R/dt = γI C’est le premier événement I ou R suite à l’introduction dans le troupeau d’un animal infecté qui déterminera l’apparition ou non d’une épidémie. γ/K= prob que le premier événement = guérison 1 -(γ/K)= prob que premier événement = transmission

Ø Et γ/K = 1/(R 0+1), d’où, si R 0 = 1, γ/K = 0. 5, il y a 1 chance sur 2 d’avoir une épidémie mineure et 1 chance sur 2 de ne pas avoir d’épidémie. Cependant R 01 a été sous estimé d’une proportion δ Ø Donc R*01=R 01+δR 01 et la valeur réelle de R*0 est donc =(ρ R*01+(1 - ρ)R 02

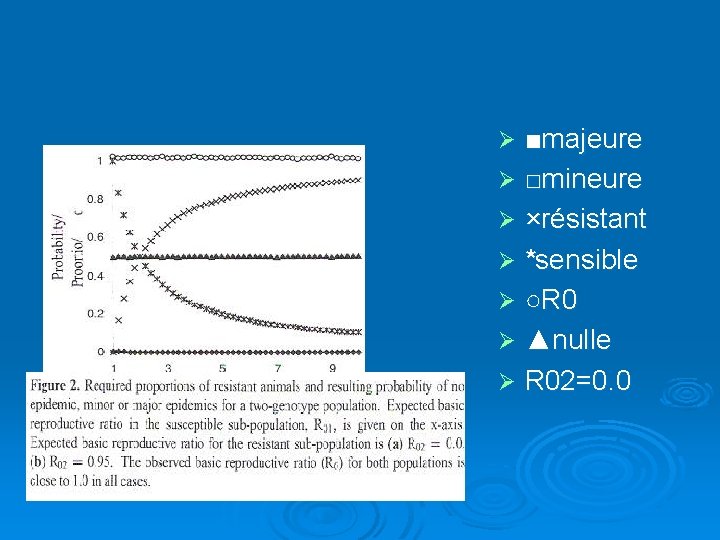
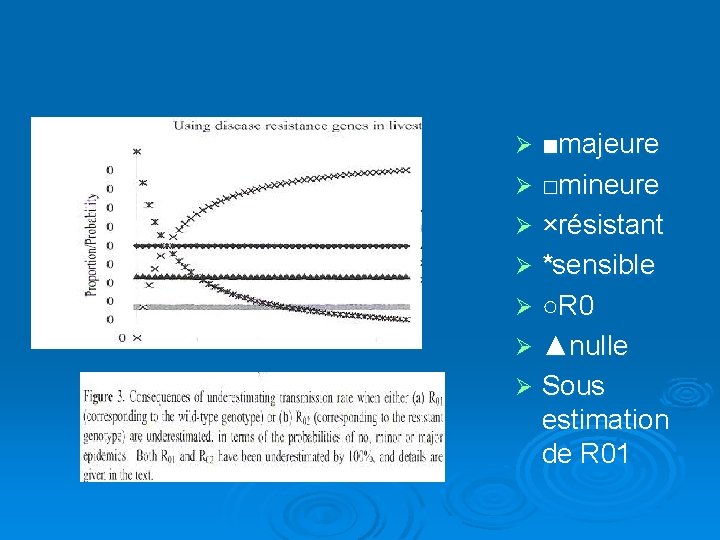
Étude prévisionnelle par une méthode de prévisions aléatoires Le modèle démontré précédemment doit être vérifié à grande échelle au moyen d’outils statistiques. Il en ressort deux types de graphes : le 1 er où R 0=1 et on donne comme valeurs à R 02 : 0 et 0. 95 Le 2ème compare une sous estimation de R 01 puis de R 02

■majeure Ø □mineure Ø ×résistant Ø *sensible Ø ○R 0 Ø ▲nulle Ø R 02=0. 0 Ø

Ø Si R 0 =1 on observe un maintien des probabilités d’épidémie mineure ou nulle à 0. 5 et une probabilité d’épidémie majeure à 0 et cela malgré la variation de R 01 Ø Pour une valeur de R 01 de 2 la population doit être composée d’autant d’individus résistants que d’individus sauvages

■majeure Ø □mineure Ø ×résistant Ø *sensible Ø ○R 0 Ø ▲nulle Ø R 02=0. 95 Ø

Ø Sur ce graphe, R 02 (transmission de l’infection chez les individus résistants) est plus élevé. Même si les probabilités des différents types d’épidémies reste inchangées, on observe une évolution bien plus rapide des populations: en effet la population sauvage doit se battre contre un phénomène déjà difficile a supporter pour la population résistante

■majeure Ø □mineure Ø ×résistant Ø *sensible Ø ○R 0 Ø ▲nulle Ø Sous estimation de R 01 Ø

Ø Ici on observe les méfaits d’une sous estimation de R 01. La probabilité d’épidémie majeure passe a 0. 5 , alors que celle d’épidémie mineure et nulle diminue cela s’explique par le fait que la population ne varie pas comme il faudrait pour s’adapter à une transmission infectieuse chez les sauvages sous estimée

■majeure Ø □mineure Ø ×résistant Ø *sensible Ø ○R 0 Ø ▲nulle Ø Sous estimation de R 02 Ø

Ø Si c’est R 02 qui est sous estimé le problème est moins grave car la population résistante tamponne le manque de prévisions des rapports de populations Ø De plus, pour les faibles valeurs de R 01 la probabilité d’épidémies mineures est même supérieure à celles d’épidémies majeures

Discussion Ø La notion de résistance englobe 2 points: - la non transmission de l’infection à partir de l’animal - la capacité de l’animal à résister à l’infection.

Application des résultats. Ø En cas d’endémie ou de pression d’infection trop forte, il y aura plus d’un animal initialement infecté. La probabilité d’épidémie augmente donc avec un facteur 1 -1/Rα 0 où α = le nombre d’animaux initialement infectés.

Il n’est pas nécessaire que tous les animaux du cheptel soient génétiquement résistants pour éradiquer l’infection. A partir d’une certaine proportion de résistance, la transmission ne pourra plus s’effectuer. Ex : Scrapie Ø Ø Les gènes de résistance à la pathologie évolueront même en absence d’infection, ainsi que la réponse immunitaire correspondante.

Évolution de l’agent pathogène. Ø En parallèle avec l’évolution des gènes de résistance, les agents pathogènes vont aussi muter. Cela engendre 2 conséquences: - le risque absolu d’évolution du pathogène est inestimable, seul le risque relatif d’une stratégie de management génétique différente peut être calculé. - la mutation est rarement bénéfique pour le pathogène sauf dans de rares cas.

Dans les populations type sauvage, la pression de sélection des pathogènes est faible. Globalement, les pressions de sélection existantes vont être un compromis entre la transmission du pathogène et sa virulence, ex : la mortalité de l’hôte diminue le pouvoir de transmission du pathogène Cependant : la stratégie de réduction de R 0 < 1 induit une sélection des pathogènes les plus résistant.

R 01 est une notion plus étendue qu’il n’y parait : l’hétérogénéité génétique. Ø En effet les agents infectieux doivent faire face a Ø l l Ø des population qui ne présentent pas les même facteurs de résistances Des individus qui présentent différents gènes de résistance Plus l’hétérogénéité génétique est grande, plus les agents infectieux on la vie dure.

conclusion La population devrait être manipulée afin que la valeur de R 0 soit inférieure à 1. Cela réduirait la probabilité d’une épidémie majeure à 0 et réduirait la probabilité d’une infection mineure en dessous de 0. 5 en cas d’infection par un animal initialement atteint. Ø Les risques d’infection mineure diminuerait en parallèle avec la diminution de R 0. Ø les stratégies de contrôle de l’infection ne devraient pas se faire sur un seul gène au risque de créer des mutants pathogènes résistants Ø

Ø Breedind for disease resistance : uniting génétics and epidemiology l Prof. steve bishop
 Rentrer chez dieu
Rentrer chez dieu Rentrer chez dieu comme on rentre chez soi robert lebel
Rentrer chez dieu comme on rentre chez soi robert lebel Ps2 practice management
Ps2 practice management échange de substances dissoutes
échange de substances dissoutes Des des des
Des des des Contrle parental software
Contrle parental software Contrle
Contrle Contrle parental software
Contrle parental software Contrle parental
Contrle parental Contrle parental
Contrle parental Contrle technique
Contrle technique Développement post embryonnaire chez les insectes
Développement post embryonnaire chez les insectes Nous sommes chez nous
Nous sommes chez nous Digestion microbienne chez les ruminants
Digestion microbienne chez les ruminants Test de coombs direct positif chez le nouveau-né
Test de coombs direct positif chez le nouveau-né Qu'est-ce que l'absurde selon camus ?
Qu'est-ce que l'absurde selon camus ? Travailler chez ibm france
Travailler chez ibm france Chez joeline
Chez joeline Entrez chez moi
Entrez chez moi Chez mylo menu
Chez mylo menu Stage chez psa
Stage chez psa Gène sry chez la femme
Gène sry chez la femme La langue de chez nous paroles
La langue de chez nous paroles Pps chez lise
Pps chez lise Vol chez le commissaire kivala
Vol chez le commissaire kivala Osteome brachial anterieur
Osteome brachial anterieur Index of kamasutra
Index of kamasutra