slo projektu CZ 1 071 5 0034 0029






- Slides: 9

Číslo projektu CZ. 1. 07/1. 5. 00/34. 0029 Číslo materiálu VY_32_INOVACE_04 -16 Název školy Střední průmyslová škola stavební, Resslova 2, České Budějovice Autor Ing. Věra Čechová Tematický celek Chemie Ročník 1. Datum tvorby 10. 7. 2012 Anotace - prezentace - úvod do teorie chemického názvosloví - procvičení oxidů Metodický pokyn Opakování, výklad i procvičení Pokud není uvedeno jinak, použitý materiál je z vlastních zdrojů autora

NÁZVOSLOVÍ 1 anorganických sloučenin – úvod - oxidy

Opakování - doplňte 1) Oxidační číslo je …………………… 2) Jiná slova pro oxidační číslo: ………………………. 3) Elektronegativita je ………………………. . 4) Oxid. č. volných prvků (např. Fe, Cl 2) jsou rovny ……… 5) ………… v molekule udávají dolní indexy, jsou to malá celá čísla 6) Názvy většiny anorganických sloučenin jsou složeny ze ………. . slov Nápověda : náboj prvku v chem. vazbě sloučeniny schopnost prvků přitahovat elektrony mocenství, valence, oxid. stupeň, náboj nule dvou Počet atomů

- Názvosloví anorganických sloučenin je vybudováno na pojmu oxidační číslo K označení oxidačních čísel prvků používáme římských číslic (u záporných s uvedením znaménka před číslicí) Sloučenina je navenek elektroneutrální, proto součet součinů oxidačních čísel a počtu atomů musí být roven nule, v případě iontu odpovídá jeho náboji. Počet atomů v molekule udávají dolní indexy, jsou to malá celá čísla Příklad: CIVO-II 2 (ne C 2 O 4) HI 2 SVIO-II 4

Další pravidla pro určení oxidačních čísel 1) Vodík má ve sloučenině oxidační číslo I s výjimkou hydridů kovů 2) Kyslík má oxidační číslo – II s výjimkou peroxidů, peroxosloučenin a sloučenin s �uorem 3) Fluor má vždy oxidační číslo – I (nejvyšší elektronegativita) 4) Kovy mají ve sloučeninách jen kladná oxidační čísla s výjimkou některých komplexních sloučenin 5) Maximální kladné oxidační číslo prvku nemůže být vyšší než je číslo skupiny periodické soustavy, do které je zařazen, s výjimkou některých přechodných kovů (Cu, Ag, Au)

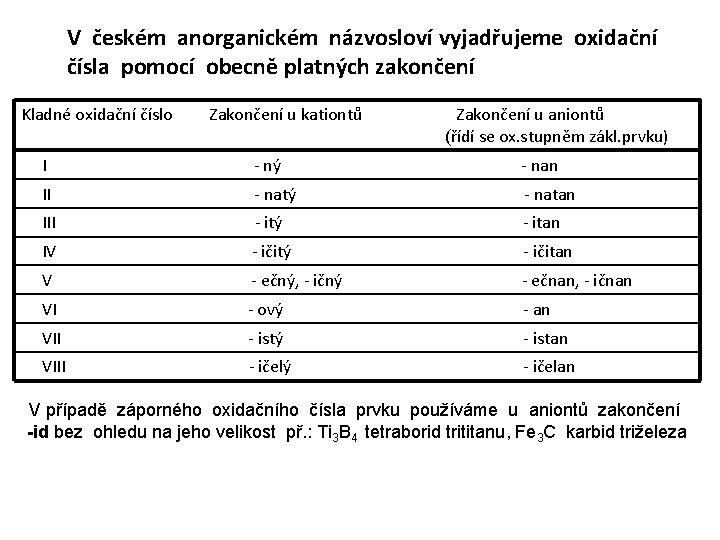
V českém anorganickém názvosloví vyjadřujeme oxidační čísla pomocí obecně platných zakončení Kladné oxidační číslo Zakončení u kationtů Zakončení u aniontů (řídí se ox. stupněm zákl. prvku) I - ný - nan II - natý - natan III - itý - itan IV - ičitý - ičitan V - ečný, - ičný - ečnan, - ičnan VI - ový - an VII - istý - istan VIII - ičelý - ičelan V případě záporného oxidačního čísla prvku používáme u aniontů zakončení -id bez ohledu na jeho velikost př. : Ti 3 B 4 tetraborid trititanu, Fe 3 C karbid triželeza

OXIDY Xm. O-IIn - oxidy jsou dvouprvkové sloučeniny kyslíku - kyslík má v oxidech vždy oxidační číslo –II - název: podstatné jméno oxid a přídavné jméno s valenční příponou př. : oxid hlinitý Al 2 O 3, oxid uhličitý CO 2 SPECIELNÍ PŘÍPAD - PEROXIDY - obsahují jednoduchou vazbu: kyslík - označení O 22− př. : peroxid vodíku H 2 O 2 peroxid sodný Na 2 O 2 -O-O-

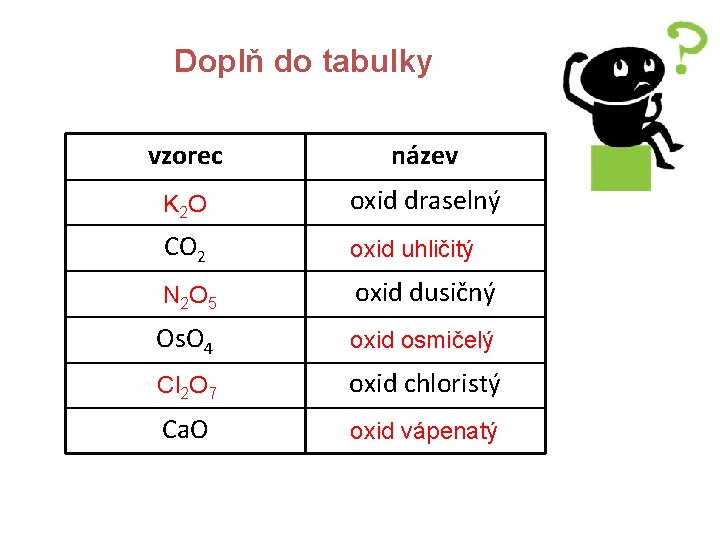
Doplň do tabulky vzorec název K 2 O oxid draselný CO 2 oxid uhličitý N 2 O 5 oxid dusičný Os. O 4 oxid osmičelý Cl 2 O 7 oxid chloristý Ca. O oxid vápenatý

Použité zdroje obrázků: - galerie Microsoft office
















