Sistema Trmicamente Isolado Sistema trmicamente isolado aquele que














- Slides: 23

Sistema Térmicamente Isolado Sistema térmicamente isolado é aquele que NÃO troca calor com o meio externo

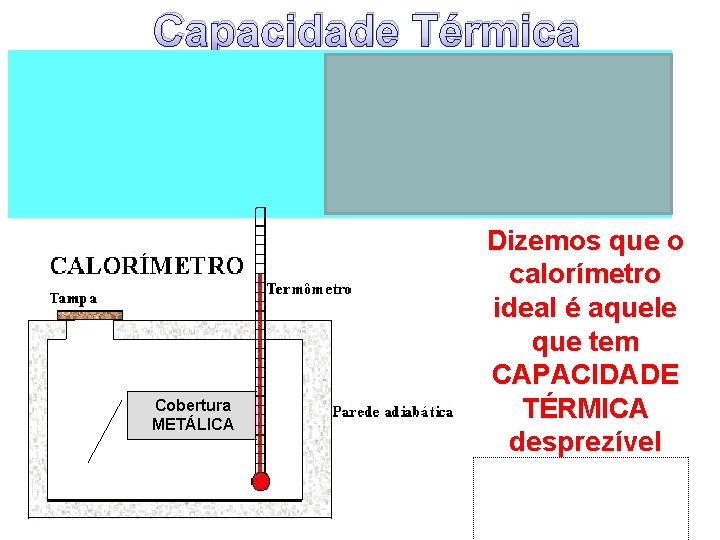
Sistema Térmicamente Isolado Para isolar o sistema utiliza-se um CALORÍMETRO Calorímetro é um aparelho utilizado em laboratório com o objetivo de minimizar as trocas de calor com o meio externo.

Capacidade Térmica Cobertura METÁLICA Dizemos que o calorímetro ideal é aquele que tem CAPACIDADE TÉRMICA desprezível (próxima a zero!)

Num Sistema Térmicamente Isolado A a c i m r é T a i g a r v e r n e E s n o C se

Sistema Térmicamente Isolado Energia Térmica se conserva Q = 0 Q 1 + Q 2 +. . . + Qn = 0

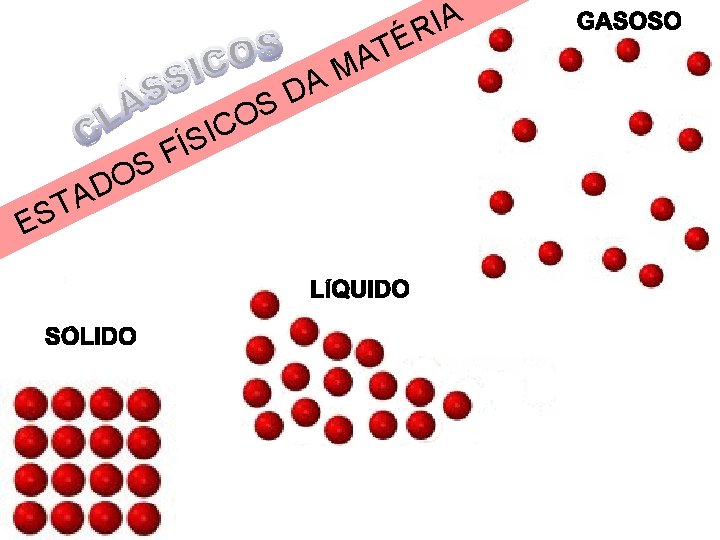
IA R É A D S O C I ÍS A T ES F S DO T A M

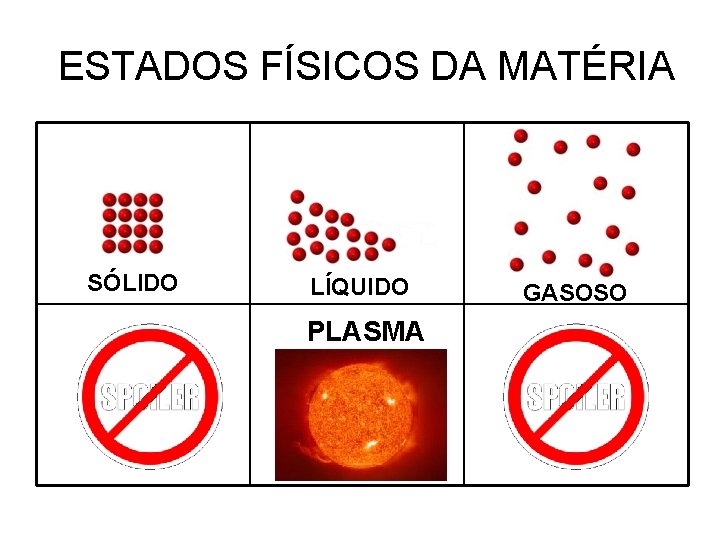
ESTADOS FÍSICOS DA MATÉRIA SÓLIDO LÍQUIDO PLASMA GASOSO

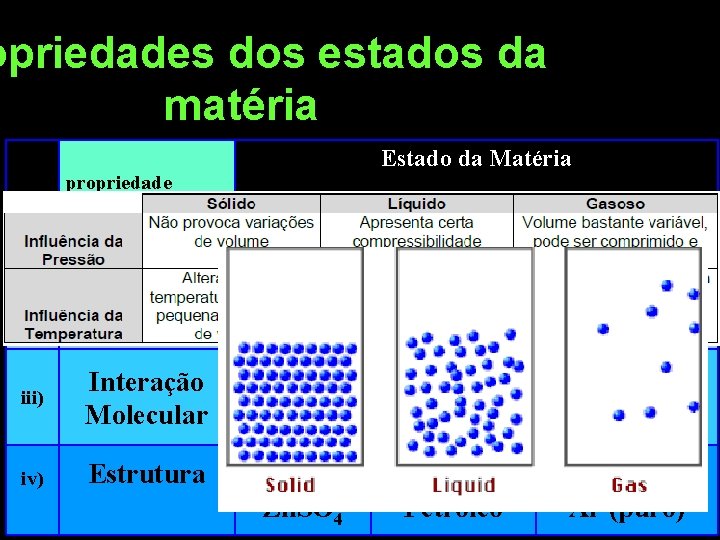
opriedades dos estados da matéria Table 9 propriedade Estado da Matéria Sólido Liquido Gás (Vapor) varia com a forma do recipiente constante varia com a forma do recipiente i) FORMA constante ii) VOLUME constante iii) Interação Molecular iv) Estrutura Muito forte. Forte. Moléculas fixas Moléculas ligadas. Na. Cl Zn. SO 4 H 2 O Petróleo fraca H 2 , CO 2 Ar (puro)


ESTADOS FÍSICOS

Plasma, é um gás ionizado constituído de elétrons livres, íons e átomos (moléculas) neutros, em proporções variadas. ☼ Principalmente nas estrelas (altas Temperaturas); ☼ Também a “baixas temperaturas” (sob ação de campos eletromagnéticos).

MUDANÇAS DE ESTADO


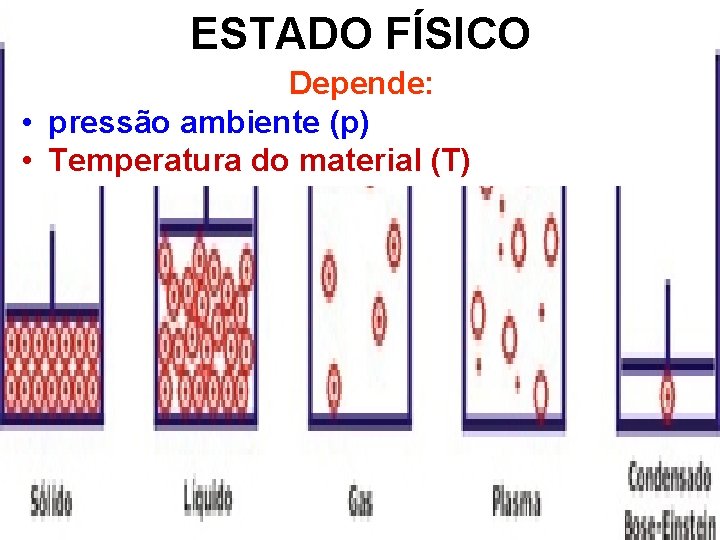
ESTADO FÍSICO Depende: • pressão ambiente (p) • Temperatura do material (T)

MUDANÇAS DE ESTADO Dependem: • pressão ambiente (p) • temperatura do material (T)

MUDANÇAS DE ESTADO • Para uma dada pressão, cada substância apresenta um ponto de fusão/solidificação e outro de ebulição/evaporação.

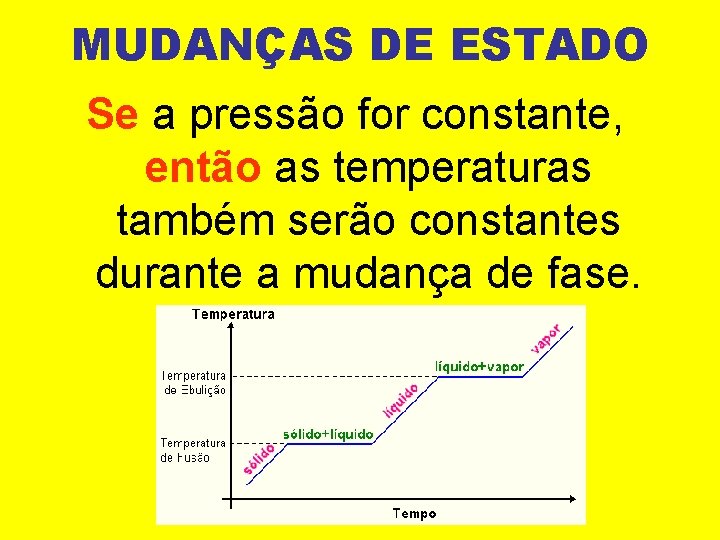
MUDANÇAS DE ESTADO Se a pressão for constante, então as temperaturas também serão constantes durante a mudança de fase.

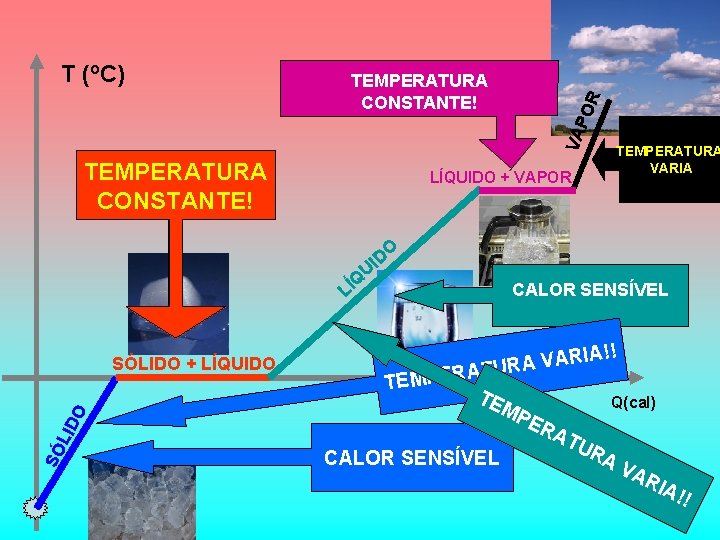
PO R CALOR LATENTE TEMPERATURA CONSTANTE! VA T (o. C) CALOR TEMPERATURA CONSTANTE! LATENTE CALOR TEMPERATURA VARIA SENSÍVEL LÍQUIDO + VAPOR O D UI Q LÍ !! TEMPE ARIA V A R U RAT TE MP SÓ LID O SÓLIDO + LÍQUIDO CALOR SENSÍVEL ER Q(cal) AT UR AV AR IA! !

QUANTIDADE DE CALOR SENSÍVEL Q=m. C. T

QUANTIDADE DE CALOR LATENTE A quantidade de calor latente que um objeto qualquer deve receber (ceder) para mudar de estado físico depende: Da massa do objeto (m); Do material do qual o objeto é feito (L) Q=m. L onde L é o calor latente do material.

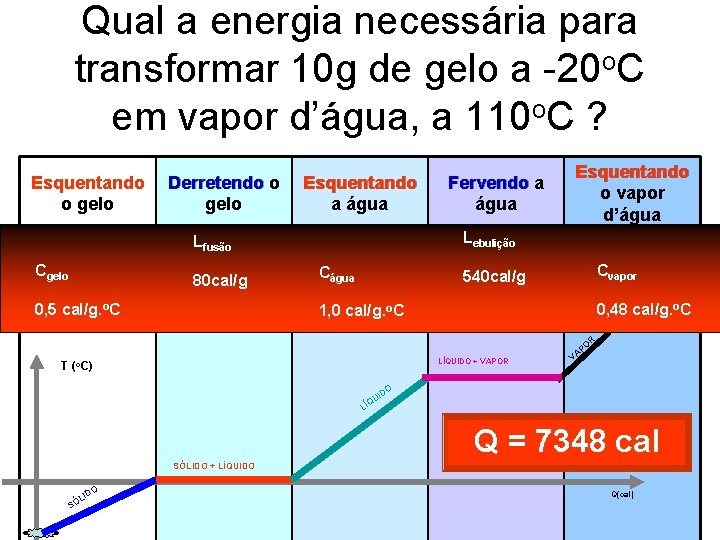
Qual a energia necessária para transformar 10 g de gelo a -20 o. C em vapor d’água, a 110 o. C ? Esquentando o gelo Q 1=m. c. T C Q 1 gelo = 10. 0, 5. 20 o. C Q 1 cal/g. = 100 cal 0, 5 Derretendo o gelo Lfusão Q 2 = m. L Q 80 cal/g 2 = 10. 80 Q 2 = 800 cal Esquentando a água Q 3 = m. c. T água Q 3 C= 10. 1. 100 o. C Q 1, 0 1000 cal 3 = cal/g. Fervendo a água Esquentando o vapor d’água Lebulição Q 5 = m. c. T Q 5 = Cvapor 10. 0, 48. 10 cal/g. o. C Q 0, 48 = 48 cal 5 Q 4 = m. L Q 4540 cal/g = 10. 540 Q 4 = 5400 cal R LÍQUIDO + VAPOR T (o. C) O AP V DO UI Q LÍ Q = 7348 cal SÓLIDO + LÍQUIDO L SÓ O ID Q(cal)

EXERCÍCIOS

LIÇÃO DE CASA Exercícios 1 a 6 pg. 296
 Sistema físico termicamente isolado
Sistema físico termicamente isolado Feliz é aquele que transfere o que sabe
Feliz é aquele que transfere o que sabe Curvas de aquecimento e resfriamento
Curvas de aquecimento e resfriamento Um recipiente termicamente isolado contém 500g de água
Um recipiente termicamente isolado contém 500g de água Em um recipiente termicamente isolado são misturados 400g
Em um recipiente termicamente isolado são misturados 400g O bom professor
O bom professor Bem aventurado o que acode o necessitado
Bem aventurado o que acode o necessitado Muito se pedirá àquele que muito recebeu
Muito se pedirá àquele que muito recebeu Quem tem um amigo tem um tesouro bíblia
Quem tem um amigo tem um tesouro bíblia Todo aquele que se eleva será rebaixado
Todo aquele que se eleva será rebaixado Todo aquele que crê em mim um dia ressurgirá partitura
Todo aquele que crê em mim um dia ressurgirá partitura Deficiente é aquele que não consegue modificar sua vida
Deficiente é aquele que não consegue modificar sua vida Todo aquele que crê em mim um dia ressurgirá
Todo aquele que crê em mim um dia ressurgirá Nao perturbeis o coração
Nao perturbeis o coração Pronomes demonstrativos
Pronomes demonstrativos Determinantes e artigos
Determinantes e artigos Como zaque eu quero subir
Como zaque eu quero subir E classe e subclasse
E classe e subclasse Este parte aquele parte
Este parte aquele parte Vaso chines parnasianismo
Vaso chines parnasianismo Cultura é aquele todo complexo
Cultura é aquele todo complexo (mackenzie) não caracteriza a estética parnasiana
(mackenzie) não caracteriza a estética parnasiana Aquele abraço virtual
Aquele abraço virtual Aquele dia
Aquele dia








































