Rui Santos Ivo Presidente do INFARMED VACINAS PARA











- Slides: 12

Rui Santos Ivo Presidente do INFARMED

VACINAS PARA A COVID-19 Desenvolvimento, aprovação e acesso

Estratégia coordenada no âmbito da União Europeia Objectivos: • • • Garantir a qualidade, a segurança e a eficácia das vacinas Garantir o acesso em tempo útil dos Estados-Membros e da sua população às vacinas e, ao mesmo tempo, liderar o esforço de solidariedade a nível mundial Garantir a todos na UE um acesso equitativo logo que possível Pilares de acção: 1 - Garantir a produção de uma quantidade suficiente de vacinas na UE através de acordos prévios de aquisição com produtores de vacinas através do Instrumento de Apoio de Emergência. Para além desses acordos, será possível mobilizar financiamento adicional e outras formas de apoio. 2 - Adaptar as regras da UE à atual urgência, a fim de acelerar o desenvolvimento, a autorização e a disponibilidade de vacinas, mantendo simultaneamente os padrões de qualidade, segurança e eficácia das vacinas. Governação: • Criação de um Conselho steering board composto por representantes de todos os Estados-Membros participantes, a fim de apoiar a Comissão com orientação e conhecimentos especializados ao longo de todo o processo. • INFARMED assegura a representação do Ministério da Saúde no Steering Board criado para o efeito

1º Pilar - Garantir a produção de uma quantidade suficiente de vacinas na UE através de acordos prévios de aquisição

Acordos prévios de Aquisição Desenvolvimento de contratos de compra antecipada centralizados na Comissão Europeia, com financiamento europeu (desenvolvimento e produção) e nacional (aquisição), para as potenciais vacinas, com os seguintes objetivos: • Assegurar processo conjunto que permita acesso uniforme às vacinas em todos os Estados-membros, com partilha de risco conjunta, dada a incerteza envolvida; • Garantir um portfolio alargado de vacinas com base nas diferentes plataformas científico-tecnológicas em desenvolvimento que tenha em conta: O prazo previsto de disponibilização; as características científicas de cada vacina (populações-alvo, doses, …); volumes, mecanismo de fornecimento e logística, custos

Acordos prévios de Aquisição Todos os países da UE terão acesso ao mesmo tempo e em função do tamanho da população Janssen (J&J) • EU 200 M • PT 4, 5 M Astrazeneca • EU 300 M • PT 6, 9 M 14/ago 18/set 21/out Curevac • EU 225 M • PT a definir 11/nov 18/set 19/nov 25/nov Sanofi/GSK Bio. NTech/Pfizer Moderna • EU 300 M • PT a definir • EU 200 M • PT 4, 5 M • EU 80 M • PT 1, 8 M

2º Pilar - Adaptar as regras da UE à atual urgência, a fim de acelerar o desenvolvimento, a autorização e a disponibilidade de vacinas, mantendo simultaneamente os padrões de qualidade, segurança e eficácia das vacinas.

EMRN - European Medicines Regulatory Network Chefes das Agências (INFARMED) + EMA Garantir alinhamento em toda a Europa: - coordenando a avaliação das vacinas COVID -19 - assegurando a robustez do processo de avaliação CHMP – Comité de Medicamentos de Uso Humano da EMA – representantes de cada Estado-membro


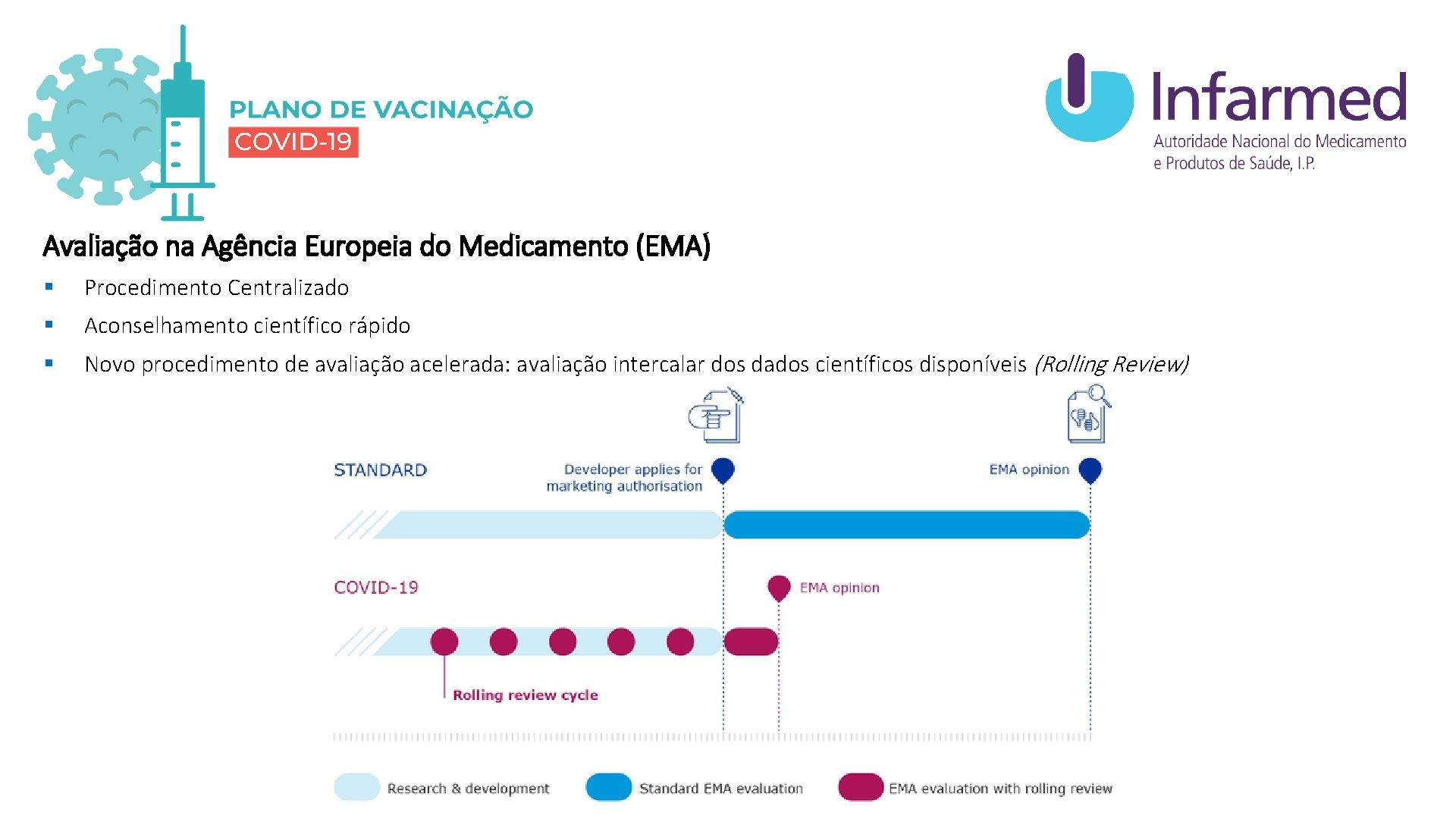
Avaliação na Agência Europeia do Medicamento (EMA) § Procedimento Centralizado § Aconselhamento científico rápido § Novo procedimento de avaliação acelerada: avaliação intercalar dos dados científicos disponíveis (Rolling Review)

AIM Condicional § para doenças graves sem alternativas terapêuticas (necessidades médicas não satisfeitas) § Em situações de emergência permite AIM logo que os dados suficientes se tornam disponíveis para demonstrar razão Beneficio/Risco favorável. § Ferramenta regulamentar rápida e pragmática que permite múltiplos controlos – Renovação anual § Obrigações específicas planeadas para fornecimento de dados adicionais após autorização: Qualidade (ex. validação de processos fabrico escala comercial, ajuste especificações), segurança e eficácia (ex. Ensaios clínicos em curso, novos ensaios – Fase 4, registros) § Garante monitorização da segurança de forma rigorosa – Sistema Europeu de Farmacovigilância + Medidas especiais para recolha estruturada de nova informação (ex. Ensaios clínicos Fase 4) – Elevada proteção da população § aplicados os mesmos padrões de segurança que para uma AIM normal Uso Emergência (EUA, UK) § Menos requisitos de demonstração de evidência qualidade, segurança e eficácia § Não permite a comercialização especificamente para Uso Temporário

Avaliação da eficácia e segurança na Agência Europeia de Medicamentos
 Tocolise
Tocolise Trplice
Trplice Martes santo significado
Martes santo significado Cuál de las frases del papa francisco te gusta porque
Cuál de las frases del papa francisco te gusta porque Funciones de la corte suprema
Funciones de la corte suprema Presidente corso di laurea
Presidente corso di laurea Eduardo perseu
Eduardo perseu Departamentos de presidencia municipal
Departamentos de presidencia municipal Presidente tesorero y secretario
Presidente tesorero y secretario Presidente secretario tesorero
Presidente secretario tesorero Presidente
Presidente Organigrama de un presidente municipal
Organigrama de un presidente municipal Atti di diritto pubblico
Atti di diritto pubblico