Qumica Ciencia que estudia la materia y sus

















![Método 4 A partir de DHfº [Levine, pg 147] Tabular DHfº para cada sustancia Método 4 A partir de DHfº [Levine, pg 147] Tabular DHfº para cada sustancia](https://slidetodoc.com/presentation_image_h2/0381641e6d430b7eb97bec687854a573/image-26.jpg)






- Slides: 33

Química: Ciencia que estudia la materia y sus transformaciones

Química: Ciencia que estudia la materia y sus transformaciones Enlace químico y estructura de la materia

Química: Ciencia que estudia la materia y sus transformaciones Enlace químico y estructura de la materia Química general

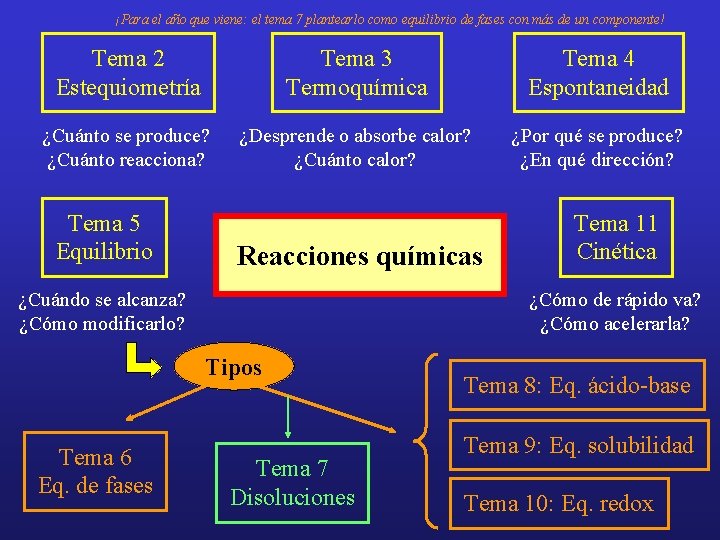
¡Para el año que viene: el tema 7 plantearlo como equilibrio de fases con más de un componente! Tema 2 Estequiometría Tema 3 Termoquímica Tema 4 Espontaneidad ¿Cuánto se produce? ¿Cuánto reacciona? ¿Desprende o absorbe calor? ¿Cuánto calor? ¿Por qué se produce? ¿En qué dirección? Tema 5 Equilibrio Reacciones químicas ¿Cuándo se alcanza? ¿Cómo modificarlo? ¿Cómo de rápido va? ¿Cómo acelerarla? Tipos Tema 6 Eq. de fases Tema 11 Cinética Tema 7 Disoluciones Tema 8: Eq. ácido-base Tema 9: Eq. solubilidad Tema 10: Eq. redox

Tema 3 La energía de las reacciones químicas

¿Qué nos interesa de una reacción química?

CONTENIDO 1. - Conceptos básicos. Sistemas, variables y procesos. 2. - Energía, calor y trabajo. 1 er Principio de la Termodinámica. 3. - Entalpía. 4. - Calor de reacción. Ley de Hess. 5. - Entalpías estándar de formación. 6. - Entalpías de enlace. 7. - Capacidad calorífica. 8. - Variación de la entalpía de reacción con la temperatura.

CONTENIDO 1. - Conceptos básicos. Sistemas, variables y procesos. 2. - Energía, calor y trabajo. 1 er Principio de la Termodinámica. 3. - Entalpía. 4. - Calor de reacción. Ley de Hess. Fundamentos de 5. - Entalpías estándar de formación. Termodinámica 6. - Entalpías de enlace. 7. - Capacidad calorífica. 8. - Variación de la entalpía de reacción con la temperatura. Termodinámica: Rama de la Física que estudia el calor, el trabajo, la energía y los cambios que ellos producen en los estados de los sistemas.

CONTENIDO 1. - Conceptos básicos. Sistemas, variables y procesos. 2. - Energía, calor y trabajo. 1 er Principio de la Termodinámica. 3. - Entalpía. Aplicación a 4. - Calor de reacción. Ley de Hess. reacc. químicas: 5. - Entalpías estándar de formación. 6. - Entalpías de enlace. Termoquímica 7. - Capacidad calorífica. 8. - Variación de la entalpía de reacción con la temperatura. Termoquímica: Rama de la Química que estudia el calor cedido o absorbido en las reacciones químicas.

1 CONCEPTOS BÁSICOS. SISTEMAS, VARIABLES Y PROCESOS. Sistema: Parte del universo que es objeto de estudio. Entorno, alrededores, medio ambiente: Resto del universo Tipos de sistemas Puede intercambiar Abierto Cerrado Aislado Materia Energía

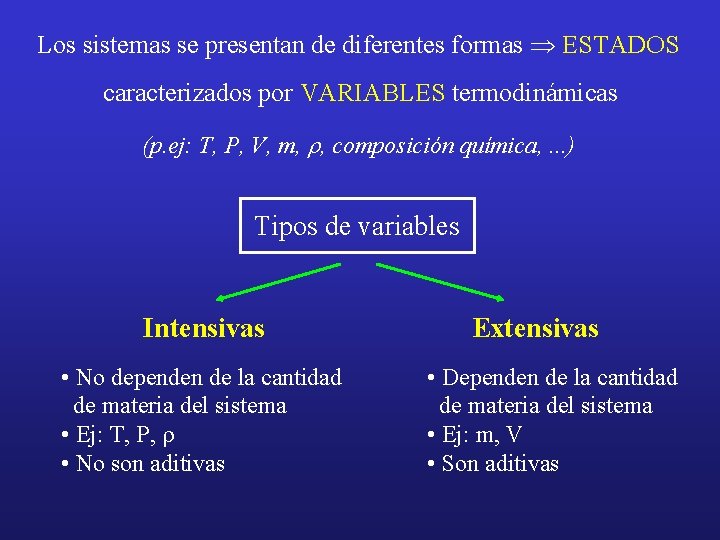
Los sistemas se presentan de diferentes formas Þ ESTADOS caracterizados por VARIABLES termodinámicas (p. ej: T, P, V, m, r, composición química, . . . ) Tipos de variables Intensivas • No dependen de la cantidad de materia del sistema • Ej: T, P, r • No son aditivas Extensivas • Dependen de la cantidad de materia del sistema • Ej: m, V • Son aditivas

Funciones de estado 1) Al asignar valores a unas cuantas, los valores de todas las demás quedan automáticamente fijados. 2) Cuando cambia el estado de un sistema, los cambios de dichas funciones sólo dependen de los estados inicial y final del sistema, no de cómo se produjo el cambio. DX = Xfinal –Xinicial Ecuaciones de estado: Relacionan funciones de estado (ej: PV = n. RT)

Cuando alguna de las variables de estado cambia con el tiempo ß PROCESO termodinámico Tipos de procesos • Isotermo • Isóbaro • Isócoro • Adiabático • Cíclico (T = cte) (P = cte) (V = cte) (Q = 0) (estado final = estado inicial) • Reversible (sistema siempre infinitesimalmente próximo al equilibrio; un cambio infinitesimal en las condiciones puede invertir el proceso) • Irreversible (Un cambio infinitesimal en las condiciones no produce un cambio de sentido en la transformación).

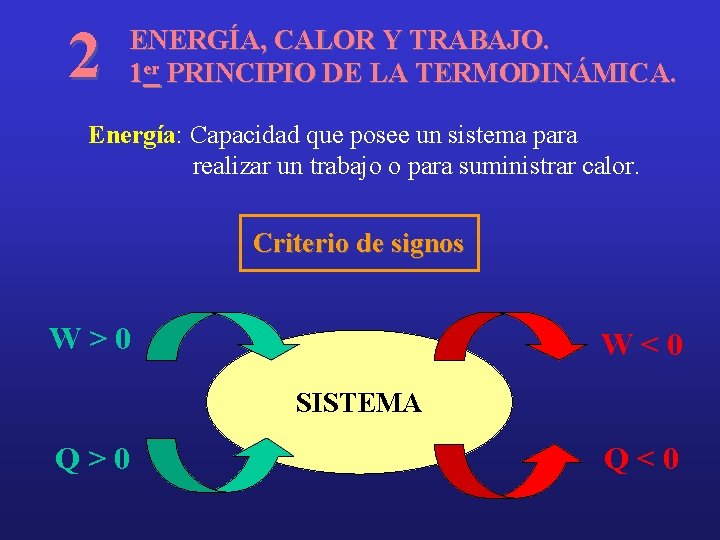
2 ENERGÍA, CALOR Y TRABAJO. 1 er PRINCIPIO DE LA TERMODINÁMICA. Energía: Capacidad que posee un sistema para realizar un trabajo o para suministrar calor. Criterio de signos W>0 W<0 SISTEMA Q>0 Q<0

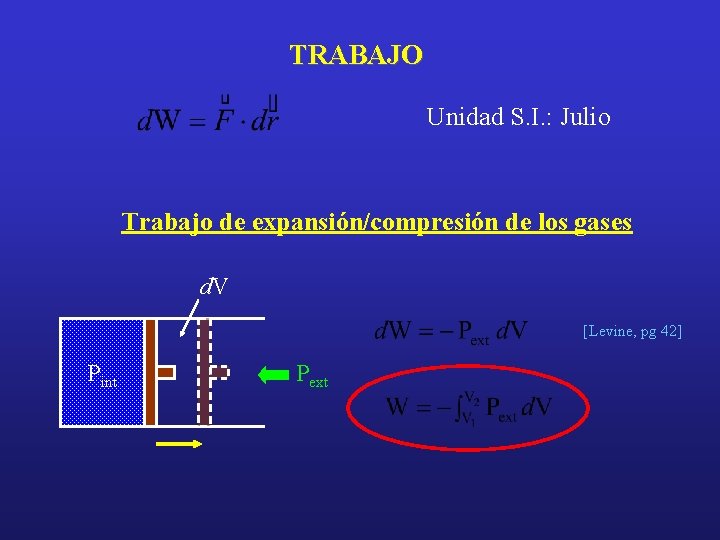
TRABAJO Unidad S. I. : Julio Trabajo de expansión/compresión de los gases d. V [Levine, pg 42] Pint Pext

Casos particulares 1) Expansión frente a una Pext constante 2) Expansión en el vacío Pext = 0 Þ W=0 [Segal, pg 590] El trabajo no es función de estado No es una propiedad característica del sistema. No es algo que posea el sistema. Es una forma de intercambio de energía, una “energía en tránsito”

Casos particulares 3) Expansión reversible isoterma de un gas ideal PV = n. RT T = cte

CALOR Un sistema cede E en forma de Q si se tranfiere como resultado de una diferencia de T entre el sistema y el entorno. Unidad S. I. : Julio 1 cal = 4. 184 J El calor no es función de estado No es una propiedad característica del sistema. No es algo que posea el sistema. Es una forma de intercambio de energía, una “energía en tránsito”

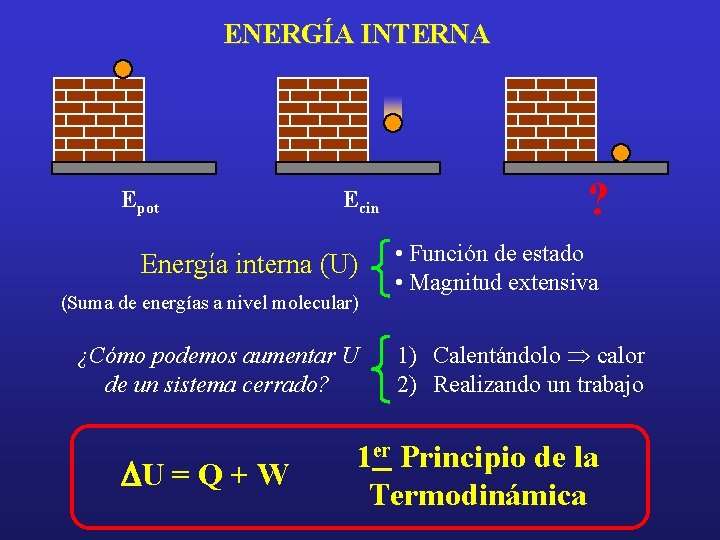
ENERGÍA INTERNA Epot Ecin Energía interna (U) (Suma de energías a nivel molecular) ¿Cómo podemos aumentar U de un sistema cerrado? DU = Q + W ? • Función de estado • Magnitud extensiva 1) Calentándolo Þ calor 2) Realizando un trabajo 1 er Principio de la Termodinámica

1 er Principio de la Termodinámica DU = Q + W Proceso a V = cte V 2 = V 1 d. V=0 Þ DU = Q + 0 = Q v • Nuevo significado de DU • Nos da una forma de determinar DU

3 ENTALPÍA. H = U + PV Entalpía (H) • Función de estado • Propiedad extensiva • Unidades de energía Proceso a P = cte Relación entre DH y DU DH = DU + D(PV) DH = DU + PDV Si P=cte solo sól/líq DH @ DU

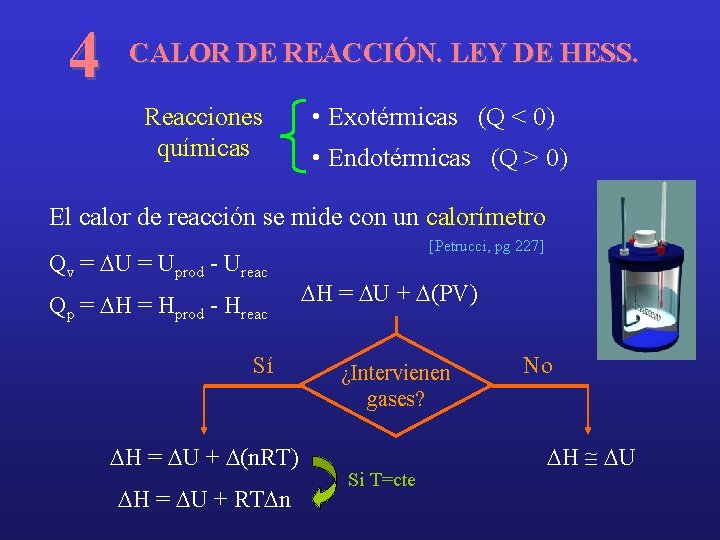
4 CALOR DE REACCIÓN. LEY DE HESS. Reacciones químicas • Exotérmicas (Q < 0) • Endotérmicas (Q > 0) El calor de reacción se mide con un calorímetro Qv = DU = Uprod - Ureac Qp = DH = Hprod - Hreac Sí DH = DU + D(n. RT) DH = DU + RTDn [Petrucci, pg 227] DH = DU + D(PV) ¿Intervienen gases? Si T=cte No DH @ DU

Entalpía de reacción Incremento de entalpía que tiene lugar durante la reacción MÉTODOS PARA DETERMINARLA Método 1 Medir Qp con un calorímetro DH = -283 k. J DH = -566 k. J DH = +283 k. J Método 2 Medir Qv con un calorímetro; DH = DU+RTDn

DH = ? DH = -393. 5 k. J Método 3 Ley de Hess El calor intercambiado cuando una reacción química se lleva a cabo a T y P constantes es el mismo tanto si la reacción ocurre en una etapa o en varias. DH = -393. 5 k. J Germain Henri Hess (1802 -1850) DH = +283 k. J DH = -110. 5 k. J H: función de estado

5 ENTALPÍA ESTÁNDAR DE FORMACIÓN. Estado estándar de una sustancia: su forma pura a 1 bar. Entalpía de reacción estándar (DHº): DH cuando los reactivos en sus estados estándar pasan a productos en sus estados estándar respectivos. Entalpía estándar de formación (DHfº) de una sustancia: Entalpía estándar de reacción para la formación de un mol de la sustancia a partir de sus elementos en su estado más estable. (Unid: J×mol-1) DHfº (C 2 H 5 OH, l) a 25ºC = -277. 69 k. J×mol-1 DHfº (elemento en su estado más estable) = 0
![Método 4 A partir de DHfº Levine pg 147 Tabular DHfº para cada sustancia Método 4 A partir de DHfº [Levine, pg 147] Tabular DHfº para cada sustancia](https://slidetodoc.com/presentation_image_h2/0381641e6d430b7eb97bec687854a573/image-26.jpg)
Método 4 A partir de DHfº [Levine, pg 147] Tabular DHfº para cada sustancia

6 ENTALPÍAS DE ENLACE. Método 5 A partir de entalpías de enlace ¡Ojo! Método aproximado Þ ESTIMACIÓN Reacción química: Proceso en el que se rompen unos enlaces y se forman otros nuevos. La ruptura/formación de un enlace conlleva intercambio energético. H H H C H H + Cl Cl H C Cl H + H Cl

6 ENTALPÍAS DE ENLACE. Método 5 A partir de entalpías de enlace ¡Ojo! Método aproximado Þ ESTIMACIÓN Reacción química: Proceso en el que se rompen unos enlaces y se forman otros nuevos. La ruptura/formación de un enlace conlleva intercambio energético. H H H C H H + Cl Cl H C Cl H + H Cl

Entalpía de disociación de un enlace dado en una molécula determinada: Energía requerida para romper ese enlace en un mol de dichas moléculas en estado gaseoso a P cte. Entalpía de enlace: Valor promedio de la energía requerida para romper enlaces similares en un gran número de moléculas diferentes. (Un mol; estado gaseoso; P cte) Þ Tabular H H H C H + Cl Cl H H C Cl + H Cl H DH = 413 + 243 – 328 – 432 = – 104 k. J ¡Ojo! * Método aproximado Þ ESTIMACIÓN Fiabilidad: ± 10 k. J como máximo * Sólo es aplicable a reacciones entre gases.

7 CAPACIDAD CALORÍFICA. Capacidad calorífica molar de una sustancia: cantidad de calor necesaria para elevar la T de un mol de dicha sustancia un grado. (Unid: J×mol-1×K-1) Calor específico de una sustancia: cantidad de calor necesaria para elevar la T de un gramo de dicha sustancia un grado. (Unid: J×g-1×K-1) Capacidad calorífica molar a P cte Capacidad calorífica molar a V cte

Cp Cv c • Magnitudes intensivas • Distintas para cada sustancia • Función de T ¿Cuál será el calor necesario para incrementar la T de n moles de una sustancia desde T 1 a T 2? A P cte: Si Cp=cte A V cte: Si Cv=cte

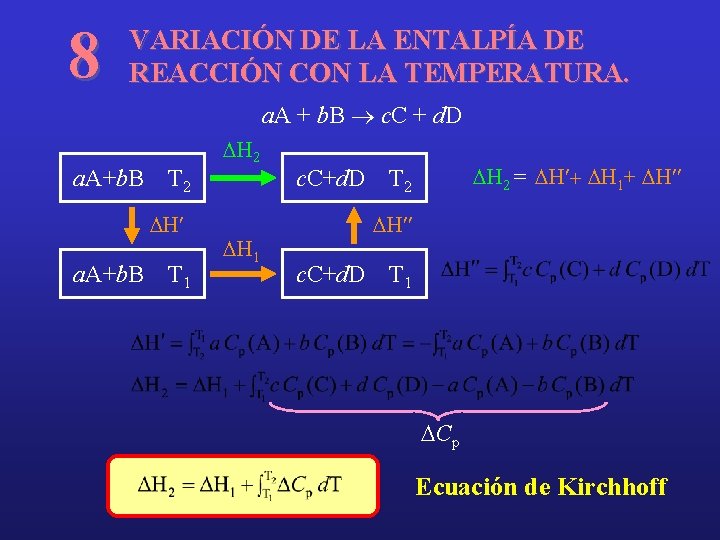
8 VARIACIÓN DE LA ENTALPÍA DE REACCIÓN CON LA TEMPERATURA. a. A + b. B ® c. C + d. D a. A+b. B T 2 DH¢ a. A+b. B T 1 DH 2 DH 1 c. C+d. D DH 2 = DH¢+ DH 1+ DH¢¢ T 2 DH¢¢ c. C+d. D T 1 DCp Ecuación de Kirchhoff

Si DCp=cte Gustav Robert Kirchhoff (1824 -1887)
 Q estudia la quimica
Q estudia la quimica Que estudia la ciencia formal
Que estudia la ciencia formal Tejido meristematico
Tejido meristematico Ciencia que estudia los suelos.
Ciencia que estudia los suelos. Ciencia que estudia los documentos
Ciencia que estudia los documentos Cinco magnitudes escalares
Cinco magnitudes escalares Que es la silvicultura
Que es la silvicultura La ciencia que estudia las bacterias
La ciencia que estudia las bacterias Solido masa
Solido masa Propiedades y características de la materia
Propiedades y características de la materia Que estudia la microeconomía
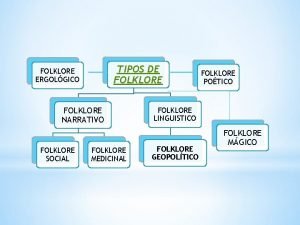
Que estudia la microeconomía Que es folklore social
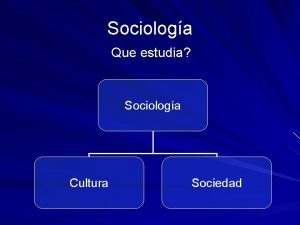
Que es folklore social Que estudia la sociologia
Que estudia la sociologia Quimica aplicada que estudia
Quimica aplicada que estudia Demoecologia
Demoecologia Msculos
Msculos Electroscopio
Electroscopio Sinecologia concepto
Sinecologia concepto Qué estudia la gramática
Qué estudia la gramática Antropologia trabajo social
Antropologia trabajo social Que estudia la hidrostática
Que estudia la hidrostática Microperspectiva del comportamiento organizacional
Microperspectiva del comportamiento organizacional Como se llama la carrera que estudia la biblia
Como se llama la carrera que estudia la biblia Filogenia botanica
Filogenia botanica Termologia slide
Termologia slide Que estudia la qu
Que estudia la qu Que estudia la sociologia segun durkheim
Que estudia la sociologia segun durkheim Que estudia la lógica informal
Que estudia la lógica informal Que es el sistema fonologico
Que es el sistema fonologico Que estudia la fonología
Que estudia la fonología Los cromosomas contienen adn
Los cromosomas contienen adn Probabilidad de color de pelo
Probabilidad de color de pelo Unidades decisorias individuales
Unidades decisorias individuales Ejemplo de un dilema moral
Ejemplo de un dilema moral