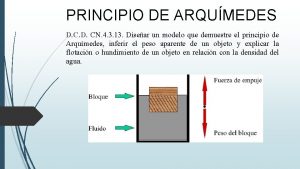
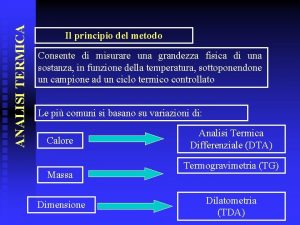
Metodo di Vohlard Principio del metodo Il metodo








- Slides: 8

Metodo di Vohlard

Principio del metodo Il metodo viene impiegato per la determinazione di ioni alogenuro quali I-, Cl-, Br-. Un eccesso noto di soluzione standard di nitrato di argento viene aggiunto al campione, e lo ione Ag+ in eccesso è determinato per retro-titolazione con una soluzione standard di tiocianato.

Nel metodo di Vohlard gli ioni argento sono titolati con una soluzione standard di ione tiocianato: Ag+ + SCN- ↔ Ag. SCN Il ferro funge da indicatore. La soluzione diventa rossa con il primo eccesso di ione tiocianato. Fe 3+ + SCN- ↔ Fe. SCN 2+ Kps = [Fe. SCN 2+] = 1, 05 x 103 [Fe 3+][SCN-] In questo caso, la concentrazione di indicatore non è critica.

La reazione avviene in ambiente fortemente acido per evitare la formazione di idrossido di ferro. Inoltre ciò rappresenta un chiaro vantaggi su altri metodi di analisi degli alogenuri perché ioni come carbonato, ossalato ed arsenato (che formano Sali poco solubili in mezzi neutri ma non in mezzi acidi) non interferiscono.

Standardizzazione di una soluzione di tiocianato di potassio • • Preparare 100 m. L di una soluzione 0. 1 N di tiocianato di potassio; Prelevare esattamente 5. 0 m. L della soluzione di Ag. NO 3 0, 10 N, aggiungere circa 3 m. L di HNO 3 3 M, circa 1 m. L di soluzione satura di allume ferrico e portare a un volume di circa 40 m. L con acqua distillata. Titolare con la soluzione di KSCN aggiungendolo lentamente e goccia a goccia sotto costante agitazione (le titolazioni di precipitazione vanno eseguite più lentamente rispetto alle titolazioni acido-base). Inizialmente si osserva la formazione di un precipitato bianco dovuto alla formazione di tiocianato di argento. La prima goccia di reagente in eccesso, rispetto al punto di equivalenza, produce una debole colorazione rossa persistente dovuta alla formazione dello ione [Fe(SCN)]2+. Prendere nota del volume di KSCN aggiunto Calcolare il titolo della soluzione di tiocianato di potassio. Eseguire almeno due titolazioni operando nelle stesse condizioni. Calcolare il valore medio del titolo della soluzione di tiocianato di potassio.

Preparazione di una solzione 0, 1 N di tiocianato di potassio P. M. = P. E. KSCN = 97, 18 g/mol Ag. NO 3 = 169, 87 g/mol N = 0, 1 g = 9, 718 gr in 1 L di acqua. Si ipotizzi di aver usato 4, 45 m. L di titolante Vi * Ci = Vf * Cf Vi = 5 m. L Ci = 0, 10 N Vf = 4, 45 m. L Cf = X Cf = 0, 112 N

Esempio applicativo L’arsenico in un campione di 9, 13 g di pesticida è stato trasformato in As. O 43 - e precipitato come Ag 3 As. O 4 con 50 m. L di Ag. NO 3 0, 02015 M. l’eccesso di Ag+ è stato poi titolato con 4, 75 m. L di KSCN 0, 04321 M. calcolare la percentuale di AS 2 O 3 presente nel campione. No mmol Ag. NO 3 = 50, 00 m. L * 0, 02015 mmol Ag. NO 3 m. L Ag. NO 3 N. mmol = 1, 0075 N. mmol Ag. NO 3 = 4, 75 m. L * 0, 04321 mmol KSCN m. L KSCN N. mmol = 0, 2052 N. Mmol Ag. NO 3 consumate dall’As. O 43 - = 1, 0075 mmol – 0, 2052 mmol = 0, 8023 As 2 O 3 = 2 As. O 43 - = 6 Ag. NO 3 As 2 O 3 = 0, 8023 mmol Ag. NO 3 x 1 mmol As 2 O 3 x 0, 1978 g As 2 O 3 6 mmol Ag. NO 3 9, 13 g di campione mmol As 2 O 3 X 100 = 0, 2897%

Bibliografia • Douglas A. Skoog, Donald M. West F. James Holler; Chimica analitica una introduzione; edizioni Edi. Ses • http: //www. chimica. unipd. it/chimind/pubblica/chim. Anal 1/modulo%20 B/argento metria%20 Cl. pdf