Lhydromtallurgie du zinc Principe de lhydromtallurgie du zinc







- Slides: 12

L’hydrométallurgie du zinc

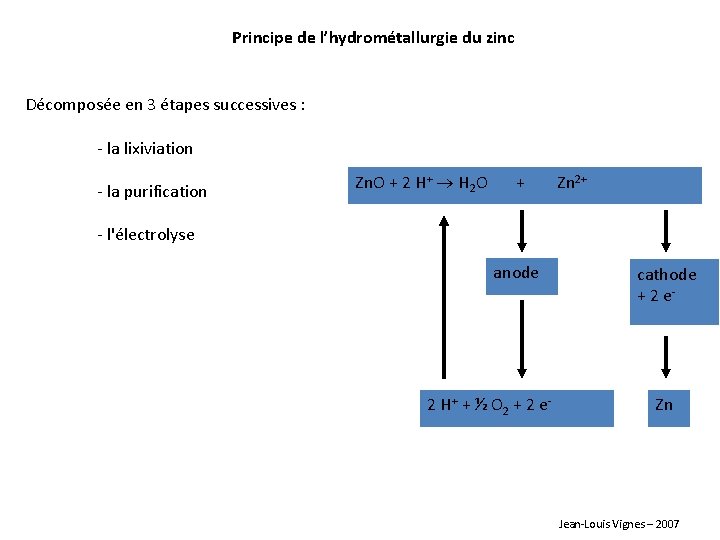
Principe de l’hydrométallurgie du zinc Décomposée en 3 étapes successives : - la lixiviation - la purification Zn. O + 2 H+ H 2 O + Zn 2+ - l'électrolyse anode 2 H+ + ½ O 2 + 2 e - cathode + 2 e- Zn Jean-Louis Vignes – 2007

La lixiviation choix de la solution lixiviante - oxydes basiques acide - quel acide choisir ? - non oxydant - non gênant pour l'électrolyse finale HCl, H 2 SO 4 - bon marché - de plus production interne lors du grillage Jean-Louis Vignes – 2007

La lixiviation - réalisée avec H 2 SO 4 2 mol. L-1, vers 60°C - lors de la lixiviation réalisation d’une 1ère purification avec élimination des composés insolubles : Au, Ag, Pb. SO 4, Si. O 2 - dissolution de la ferrite : emploi de H 2 SO 4 concentré à 95°C Jean-Louis Vignes – 2007

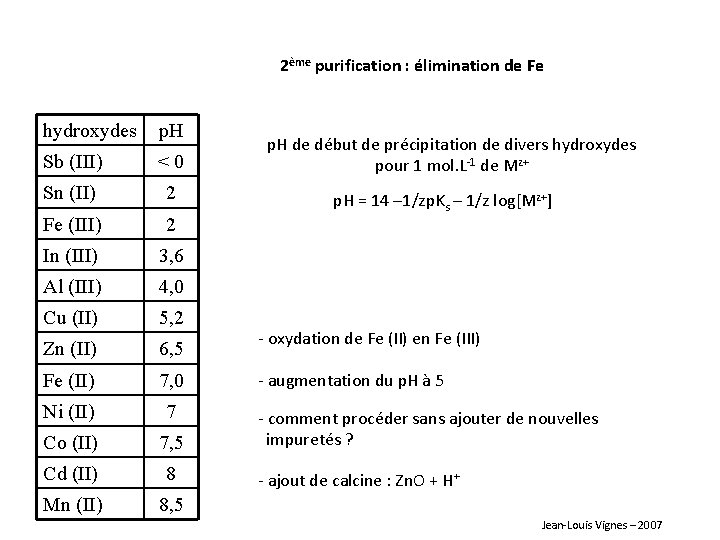
2ème purification : élimination de Fe hydroxydes p. H Sb (III) <0 Sn (II) 2 Fe (III) 2 In (III) 3, 6 Al (III) 4, 0 Cu (II) 5, 2 Zn (II) 6, 5 Fe (II) 7, 0 Ni (II) 7 Co (II) 7, 5 Cd (II) 8 Mn (II) 8, 5 p. H de début de précipitation de divers hydroxydes pour 1 mol. L-1 de Mz+ p. H = 14 – 1/zp. Ks – 1/z log[Mz+] - oxydation de Fe (II) en Fe (III) - augmentation du p. H à 5 - comment procéder sans ajouter de nouvelles impuretés ? - ajout de calcine : Zn. O + H+ Jean-Louis Vignes – 2007

2ème purification : élimination de Fe problème de la floculation de l'"hydroxyde" de fer (III) - l'"hydroxyde" de fer (III) reste en suspension stable - difficile à éliminer par décantation ou filtration - changement de la nature du précipité : procédé "à la jarosite" 6 Fe 3+ + 4 SO 42 - + 2 NH 4+ + 6 H 2 O Fe 6(OH)12(SO 4)4(NH 4)2 + 12 H+ la jarosite est le témoin de la présence d'eau sur Mars Jean-Louis Vignes – 2007

2ème purification : élimination de Fe - Élimination de : Fe, Al, Ga, In, Sb, Sn, As, Ge et Cu partiellement - Composition de la solution après la 2ème purification Zn 2+ Mg 2+ Mn 2+ 150 g. L-1 5 à 15 g. L-1 2 à 10 g. L-1 Cu 2+ Cd 2+ Co 2+ Ni 2+ 0, 1 à 1 0, 1 à 0, 5 1 à 20 g. L-1 mg. L-1 2 à 10 mg. L-1 Jean-Louis Vignes – 2007

3ème et dernière purification cémentation - Comment réduire Cu 2+, Ni 2+, Co 2+, Cd 2+ sans apporter de nouvelles impuretés ? - à l'aide de Zn - c'est une réaction liquide-solide qui impose une grande surface de réaction - poudre fine de Zn : 30 mm E°(V) Cu 2+ H+ Cu H 2 Ni 2+ Co 2+ Ni Co Cd 2+ Cd Zn 2+ Zn Mn 2+ Mn - obtention d'un cément traité par ailleurs Jean-Louis Vignes – 2007

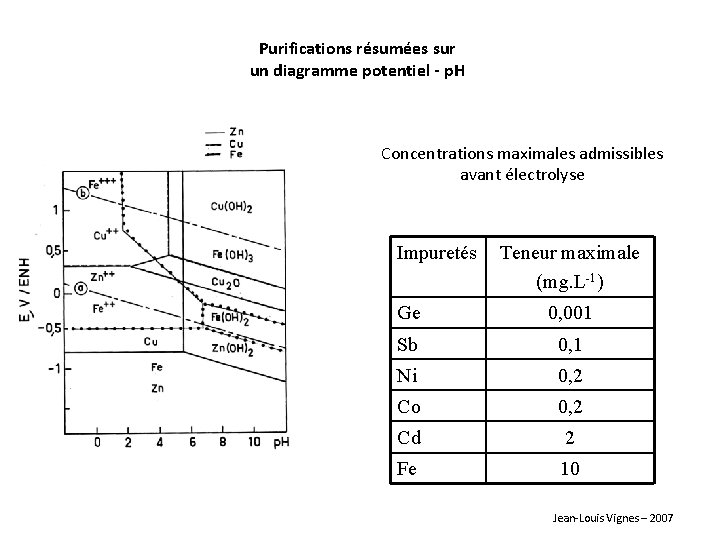
Purifications résumées sur un diagramme potentiel - p. H Concentrations maximales admissibles avant électrolyse Impuretés Teneur maximale (mg. L-1) Ge 0, 001 Sb 0, 1 Ni 0, 2 Co 0, 2 Cd 2 Fe 10 Jean-Louis Vignes – 2007

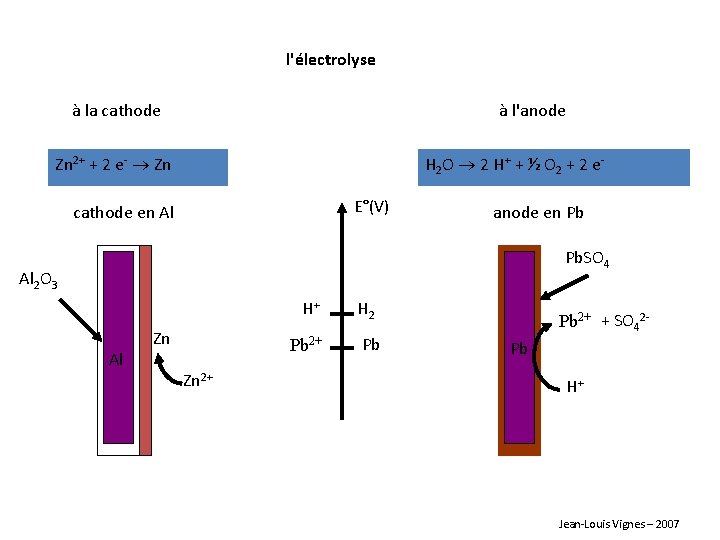
l'électrolyse à la cathode à l'anode Zn 2+ + 2 e- Zn H 2 O 2 H+ + ½ O 2 + 2 e. E°(V) cathode en Al anode en Pb Pb. SO 4 Al 2 O 3 H+ Al Zn Pb 2+ Zn 2+ H 2 Pb Pb 2+ + SO 42 Pb H+ Jean-Louis Vignes – 2007

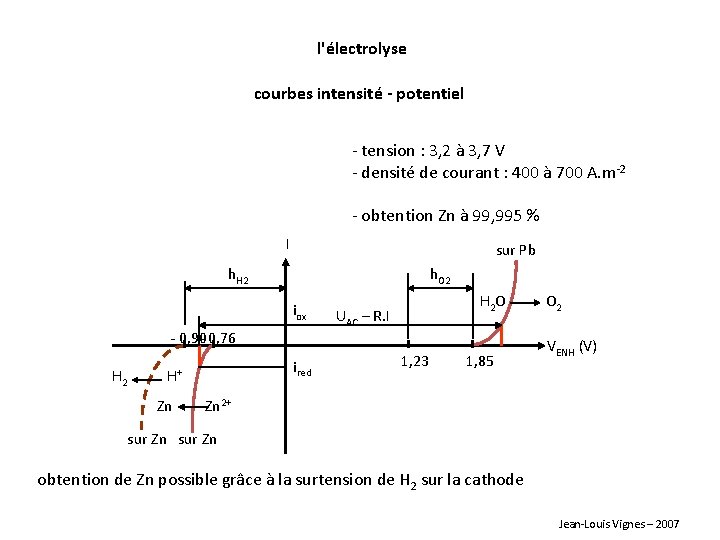
l'électrolyse courbes intensité - potentiel - tension : 3, 2 à 3, 7 V - densité de courant : 400 à 700 A. m-2 - obtention Zn à 99, 995 % I sur Pb h. H 2 h. O 2 iox - 0, 90 - 0, 76 H 2 ired H+ Zn H 2 O UAC – R. I 1, 23 1, 85 O 2 VENH (V) Zn 2+ sur Zn obtention de Zn possible grâce à la surtension de H 2 sur la cathode Jean-Louis Vignes – 2007

l'électrolyse Hall d'électrolyse de l'usine Umicore de Balen (Belgique) - 140 cellules avec par cellule : - 96 cathodes - 97 anodes - surface électrodes : 3, 2 m 2 - durée de dépôt : 40 h - production : 740 t/jour Jean-Louis Vignes – 2007
 Examples of a chemical change
Examples of a chemical change Giant molecular structure vs simple molecular structure
Giant molecular structure vs simple molecular structure Occurrence of zinc
Occurrence of zinc Zinc finger structure
Zinc finger structure Electrolyse iodure de zinc
Electrolyse iodure de zinc Zinc dissolves in hydrochloric acid to yield hydrogen gas
Zinc dissolves in hydrochloric acid to yield hydrogen gas Zinc lewis dot structure
Zinc lewis dot structure Water fluid
Water fluid Mini zinc
Mini zinc Zinc ethyl silicate primer
Zinc ethyl silicate primer Base cavitaria
Base cavitaria Copper oxide and magnesium equation
Copper oxide and magnesium equation Deficiencia de calcio en café
Deficiencia de calcio en café