LEYES PONDERALES Fuente Archivos de departamento Qumica 1

















- Slides: 20

LEYES PONDERALES Fuente: Archivos de departamento / Química 1, Ed. Santillana, 2018.

LEYES DE COMBINACIÓN QUÍMICA. Son llamadas también leyes ponderales y se trata de 4 leyes que avalan o demuestran que el átomo es la estructura básica de la materia, que tienen una masa definida (la cual no cambia en una reacción química) y que los compuestos se forman por la combinación de átomos de elementos en una razón simple de números enteros. Las 4 leyes son: 1) Ley de conservación de la masa. 2) Ley de las proporciones definidas. 3) Ley de las proporciones múltiples y recíprocas. 4) Ley de volúmenes de combinación.

1) LEY DE CONSERVACIÓN DE LA MASA. Se puede enunciar como «En una reacción química ordinaria la masa permanece constante, es decir, la masa consumida de los reactivos es igual a la masa obtenida de los productos» . Este es el principal principio de la química, siempre la suma de las masas de los reactantes será igual a la de los productos, haciendo posible que las reacciones se equilibren.

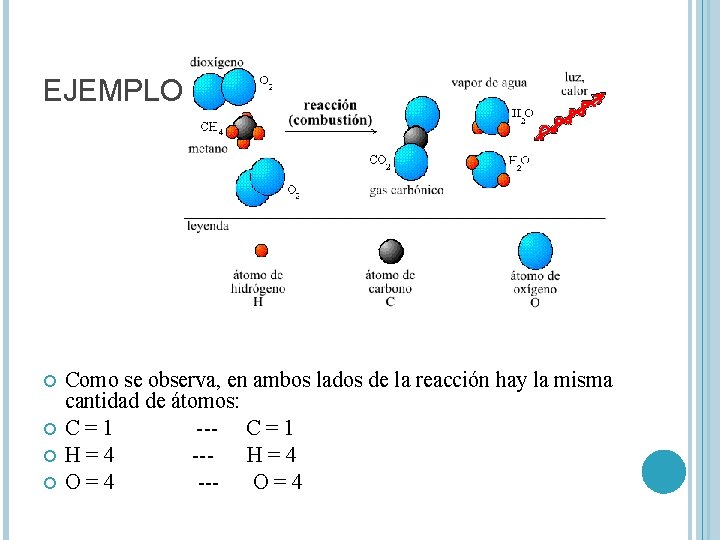
EJEMPLO: Como se observa, en ambos lados de la reacción hay la misma cantidad de átomos: C=1 --- C = 1 H=4 --H=4 O=4 --O=4

VEAMOS UN EJEMPLO CON NÚMEROS: Según Lavoisier, en la reacción del cobre con el azufre para originar sulfuro cúprico, mediante: Cu + S Cu. S resulta que 4, 00 g de Cu reaccionan con 2, 02 g de S y producen 6, 02 g de Cu. S. Es decir, que: en una reacción química, la materia ni se crea ni se destruye, sólo se reorganiza.

¿QUÉ UTILIDAD TIENE ESTA LEY? Se aplica no sólo para calcular masas de reactivos y productos, sino que también para realizar balance de reacciones. Todos los balances de reacciones se basan en esta ley.

2) LEY DE PROPORCIONES DEFINIDAS O FIJAS. Joseph Louis Proust (1754 -1826) sostenía que «la composición porcentual de un compuesto químico era siempre la misma, independientemente de su origen» Con el tiempo, se impuso el criterio de Proust apoyado en un experimento realizado en 1799, demostrando que la composición del carbonato cúprico era siempre la misma, cualquiera que fuese su método de obtención en la naturaleza o en el laboratorio: 5 partes de cobre, 4 de oxígeno y 1 de carbono.

Por lo tanto, los elementos se combinan para formar compuestos, y siempre lo hacen en proporciones fijas y definidas. Para determinar las proporciones de los elementos, ahora nos basta con observar sus subíndices en sus fórmulas, pero si queremos saber su proporción a partir de sus masas debemos hacer otro procedimiento.

La constitución, por ejemplo, del cloruro sódico indica que para formar 5 g de cloruro sódico, se necesitan 3 g de cloro y 2 g de sodio, por lo que la proporción entre las masas de ambos elementos es: 3 g de Cl / 2 g de Na = 1, 5 Sin embargo, si hacemos reaccionar ahora 10 g de cloro con otros 10 g de sodio, no obtendremos 20 g de cloruro sódico, sino una cantidad menor, debido a que la relación de combinación entre ambas masas siempre es 1, 5 por lo que: 3 g de Cl / 10 g de Cl = 2 g de Na / x g de Na x = 6, 6 g de Na que reaccionan

3) LEY DE PROPORCIONES MÚLTIPLES Y RECIPROCAS En 1803, John Dalton estableció la ley de las proporciones múltiples, que plantea que “cuando dos elementos se combinan para formar mas de un compuesto, la masa de uno de ellos, que se une a una masa fija del otro, esta en relación de números enteros y sencillos, como 1: 2, 3: 1 y 2: 3”. En palabras simples, significa que los elementos se combinan para formar compuestos usando números enteros sencillos.

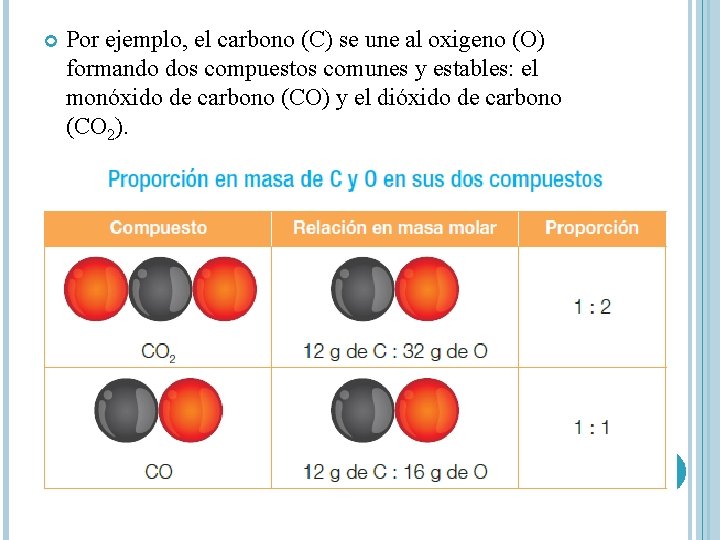
Por ejemplo, el carbono (C) se une al oxigeno (O) formando dos compuestos comunes y estables: el monóxido de carbono (CO) y el dióxido de carbono (CO 2).

Un poco antes del postulado de Dalton, en 1792, Ritcher descubrió que si dos elementos (A y B) se combinan con C en una proporción fija, cuando A y B reaccionan entre sí, lo hacen en la misma cantidad que reaccionaron con C o en múltiplos sencillos. Esto se conoce como Ley de proporciones recíprocas.

EJEMPLO:

4) LEY DE VOLÚMENES DE COMBINACIÓN En 1809, Gay-Lussac estableció esta ley y planteó que «cuando reaccionan gases bajo condiciones de temperatura y presión equivalentes, lo hacen en relaciones de volúmenes de números enteros y sencillos» .

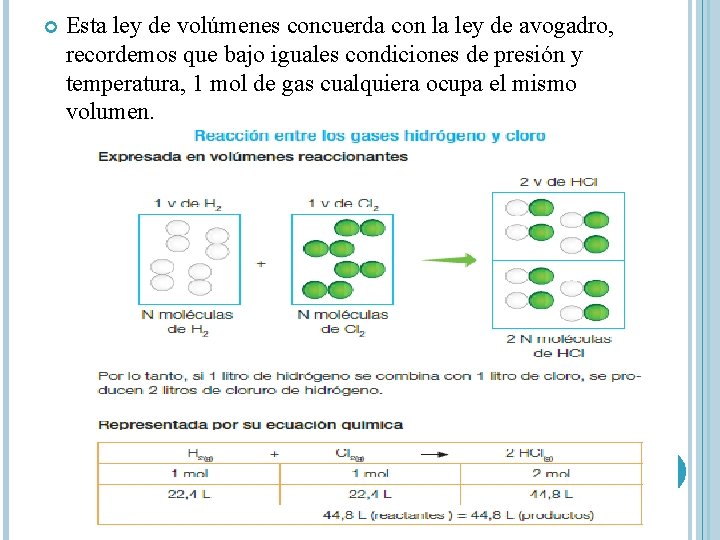
Esta ley de volúmenes concuerda con la ley de avogadro, recordemos que bajo iguales condiciones de presión y temperatura, 1 mol de gas cualquiera ocupa el mismo volumen.

¿QUÉ UTILIDAD TIENEN ESTAS LEYES? A partir de estas leyes se puede conocer la composición porcentual y a su vez, la formulación química. Antes de conocer las fórmulas químicas de los compuestos, los químicos debieron hacer experimentos para determinar la masa formada por distintas cantidades de reactivos; con estas leyes, se estableció que existe una proporción fija para combinar elementos y por tanto para formar compuestos.

VEAMOS UN CASO: Un estudiante quiso usar un compuesto «X» que se sabe contiene carbono e hidrogeno y una masa molar de 28 g/mol. Si el compuesto contiene un 14, 28% de Hidrogeno. ¿Cómo podría determinar su fórmula química? Para esto hay que aclarar que existen dos tipos de fórmula química: 1) Fórmula Empírica: corresponde a la mínima relación entre los elementos y viene dada por la expresión de la ley de proporciones fijas. 2) Fórmula Molecular: establece la relación real entre los elementos que forman el compuesto.

PASOS PARA RESOLVER EL EJERCICIO. 1) Convertir el valor porcentual en gramos. De este modo: 100 g de compuesto, tendrán 14, 28 gramos de hidrogeno y 85, 72 gramos de Carbono [100 -14, 28]. 2) Convertir los gramos anteriores en mol: Mol de H = 14, 28 gramos / 1 g/mol = 14, 28 mol Mol de C = 85, 72 gramos / 12 g/mol = 7, 14 mol

3) Dividir cada mol por el valor más pequeño obtenido. Para el Hidrogeno: 14, 28 mol / 7, 14 mol = 2 Para el Carbono: 7, 14 mol / 7, 14 mol = 1 4) El valor obtenido indica la proporción de combinación o proporción fija. En este caso: 2 mol de H con 1 mol de Carbono, queda: C 1 H 2 fórmula empírica.

5) La fórmula empírica se transforma en molecular usando la masa molar conocida del compuesto. En el ejemplo, la masa molar es 28 g/mol. Si la F. E. es: CH 2; su masa molar sería 14 g/mol [C = 12 y H = 1] Por lo tanto, se establece que: 28 / 14 = 2. Se amplifica por este valor la F. E: C(1 x 2) H(2 x 2) = C 2 H 4 Fórmula molecular.
 Leyes ponderales ejercicios resueltos 3 eso
Leyes ponderales ejercicios resueltos 3 eso Que es un mol
Que es un mol Energia de ionizacion
Energia de ionizacion Tipos de archivos
Tipos de archivos Concepto de sistema de archivo
Concepto de sistema de archivo Aedii
Aedii Flujos y archivos en programacion orientada a objetos
Flujos y archivos en programacion orientada a objetos Compresores de archivos y backup
Compresores de archivos y backup Almacenamiento de archivos distribuido
Almacenamiento de archivos distribuido Sistemas de archivos introduccion
Sistemas de archivos introduccion Sistemas de archivos distribuidos
Sistemas de archivos distribuidos Modelos de archivos
Modelos de archivos Ficheros binarios c++
Ficheros binarios c++ Federación internacional de archivos fílmicos
Federación internacional de archivos fílmicos Tipos de archivos no ejecutables
Tipos de archivos no ejecutables System.dat proceso de mantenimiento
System.dat proceso de mantenimiento Objetivos del departamento de enfermería
Objetivos del departamento de enfermería Potencialidad de cochabamba
Potencialidad de cochabamba Organigrama de departamento de contabilidad
Organigrama de departamento de contabilidad Ies suel naturales
Ies suel naturales Finestra terapeutica
Finestra terapeutica