Leyes ponderales Ley de las proporciones mltiples La




- Slides: 8

Leyes ponderales

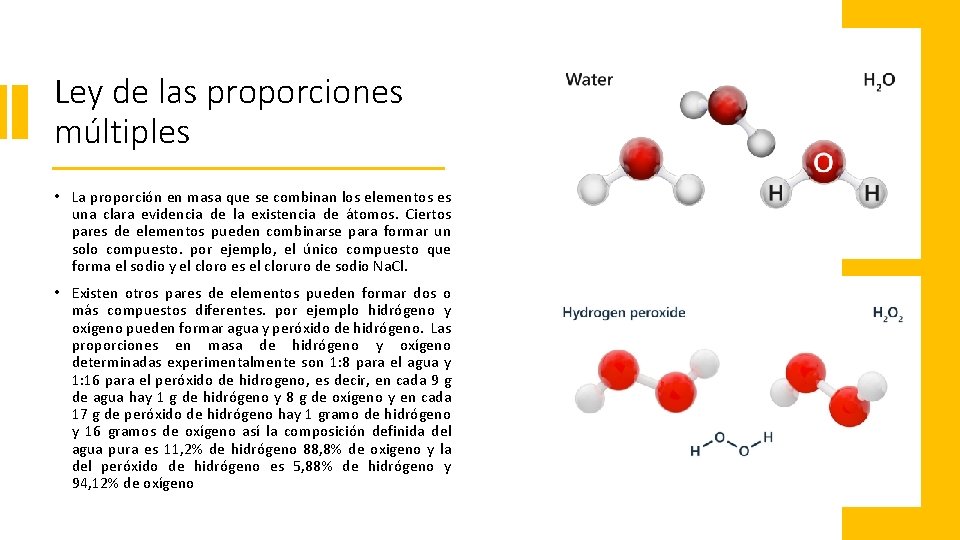
Ley de las proporciones múltiples • La proporción en masa que se combinan los elementos es una clara evidencia de la existencia de átomos. Ciertos pares de elementos pueden combinarse para formar un solo compuesto. por ejemplo, el único compuesto que forma el sodio y el cloro es el cloruro de sodio Na. Cl. • Existen otros pares de elementos pueden formar dos o más compuestos diferentes. por ejemplo hidrógeno y oxígeno pueden formar agua y peróxido de hidrógeno. Las proporciones en masa de hidrógeno y oxígeno determinadas experimentalmente son 1: 8 para el agua y 1: 16 para el peróxido de hidrogeno, es decir, en cada 9 g de agua hay 1 g de hidrógeno y 8 g de oxígeno y en cada 17 g de peróxido de hidrógeno hay 1 gramo de hidrógeno y 16 gramos de oxígeno así la composición definida del agua pura es 11, 2% de hidrógeno 88, 8% de oxigeno y la del peróxido de hidrógeno es 5, 88% de hidrógeno y 94, 12% de oxígeno

• En 1803, John Dalton estableció la Ley de las proporciones múltiples que plantea que “cuando dos elementos se combinan para formar más de un compuesto, la masa de uno de ellos, que se une a una masa fija del otro está en relación de números enteros y sencillos”

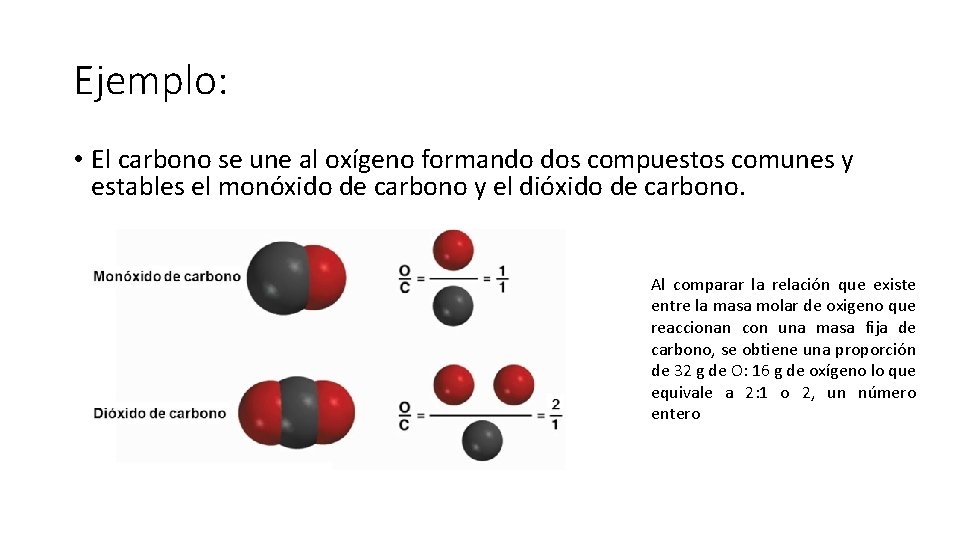
Ejemplo: • El carbono se une al oxígeno formando dos compuestos comunes y estables el monóxido de carbono y el dióxido de carbono. Al comparar la relación que existe entre la masa molar de oxigeno que reaccionan con una masa fija de carbono, se obtiene una proporción de 32 g de O: 16 g de oxígeno lo que equivale a 2: 1 o 2, un número entero

Veamos el siguiente video • QUÍMICA. Ley ponderal: ley de Dalton o de las proporciones múltiples. Teoría + ejercicio típico • https: //www. youtube. com/watch? v=9 D 2 i. K_1 Qpqs

Ley de las proporciones reciprocas En 1792, el químico alemán Jeremías Richter postulo que, si dos elementos, A y B reaccionaban con una misma cantidad de un elemento C, al reaccionar entre sí los dos primeros lo harían en las mismas cantidades que reaccionaron con CO en múltiplos sencillos. La ley de las proporciones recíprocas o de Richter establece que las masas de 2 elementos que se combinan con la masa de un tercer elemento, conservan la misma proporción que las masas de los dos cuando se combinan entre sí. Esta ley puede considerarse como una consecuencia de la ley de las proporciones definidas y de las proporciones aritméticas de las proporciones

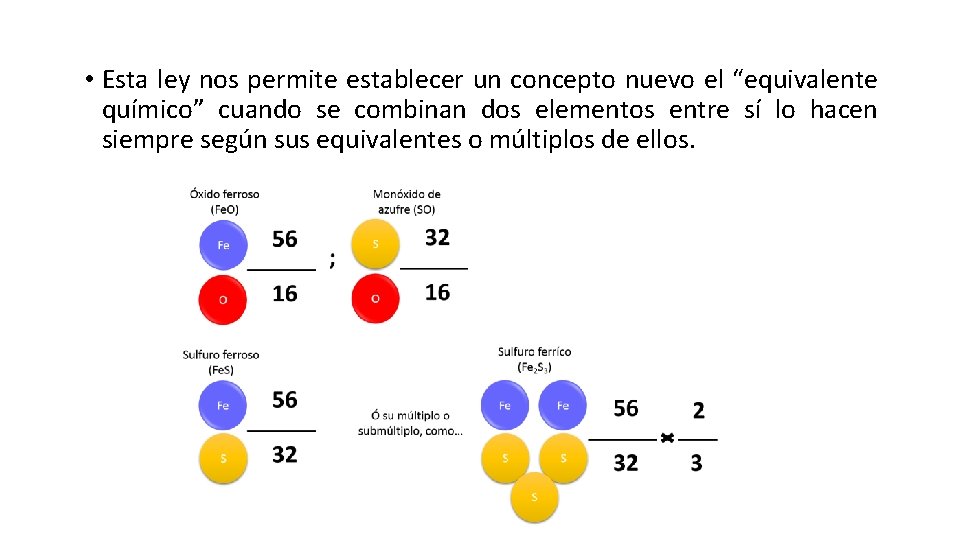
• Esta ley nos permite establecer un concepto nuevo el “equivalente químico” cuando se combinan dos elementos entre sí lo hacen siempre según sus equivalentes o múltiplos de ellos.

Veamos el siguiente video • Ley de proporciones reciprocas o ley de Richter • https: //www. youtube. com/watch? v=Oq. Lzon. Kw 4 Bo