Nivelacin N 14 Leyes ponderales y ajuste de











- Slides: 21

Nivelación N 14: Leyes ponderales y ajuste de ecuaciones Químicas


Sabias que: Si tomamos distintos elementos químicos y los ponemos en contacto para que reaccionen nos daremos cuenta de que esto no sucederá siempre de forma espontánea. Para que se formen los compuestos químicos es necesario que cada uno de los elementos que los componen (ya sean iguales o diferentes) interactúe entre sí, de tal forma que puedan establecer enlaces que los mantengan unidos y no continúen siendo átomos aislados.

Desarrollo del tema: Estructura de Lewis y regla del octeto El concepto de configuración electrónica sirve para clasificar y ordenar los elementos químicos en la tabla periódica. Esto, a su vez, nos ayuda a explicar por qué se forman las moléculas y los compuestos químicos. Esta regla postula que “cuando se forma un enlace químico los átomos reciben, ceden o comparten electrones, de tal forma que la capa más externa de cada átomo contiene ocho electrones y así adquiere la estructura electrónica del gas noble más cercano en el sistema periódico. ” Por lo tanto: Ø Los átomos alcanzan su máxima estabilidad cuando poseen 8 electrones en su última capa, con las subcapas s y p completas. Ø Para conseguir lo anterior, en unos casos se transfieren electrones de un átomo a otro, formándose iones (enlace iónico); en otros, comparten uno o más pares de electrones (enlace covalente). (Se verá con detalle la siguiente semana) Ø Dependiendo de su electronegatividad, habrán átomos que cedan y otros que capten electrones.

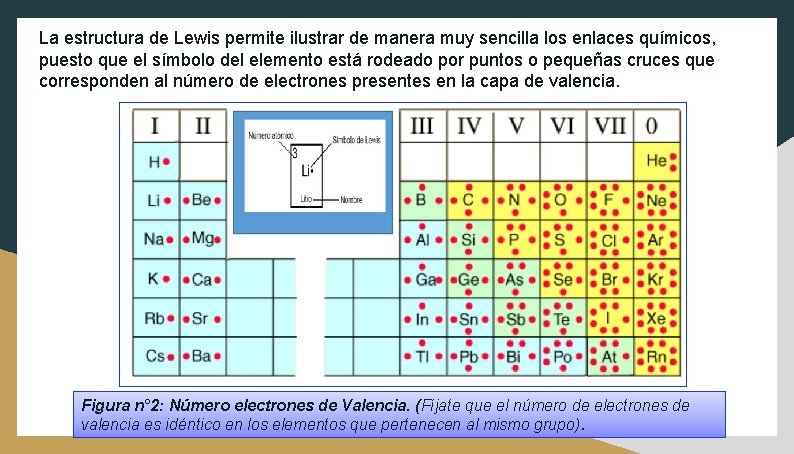
La estructura de Lewis permite ilustrar de manera muy sencilla los enlaces químicos, puesto que el símbolo del elemento está rodeado por puntos o pequeñas cruces que corresponden al número de electrones presentes en la capa de valencia. Figura n° 2: Número electrones de Valencia. (Fíjate que el número de electrones de valencia es idéntico en los elementos que pertenecen al mismo grupo).

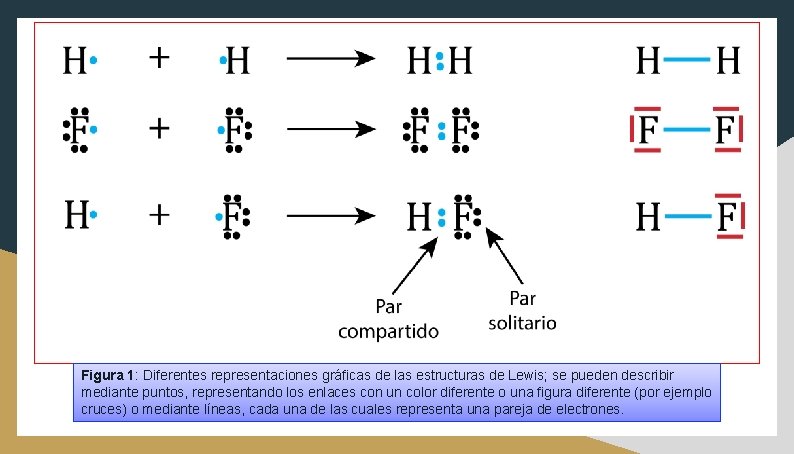
Figura 1: Diferentes representaciones gráficas de las estructuras de Lewis; se pueden describir mediante puntos, representando los enlaces con un color diferente o una figura diferente (por ejemplo cruces) o mediante líneas, cada una de las cuales representa una pareja de electrones.

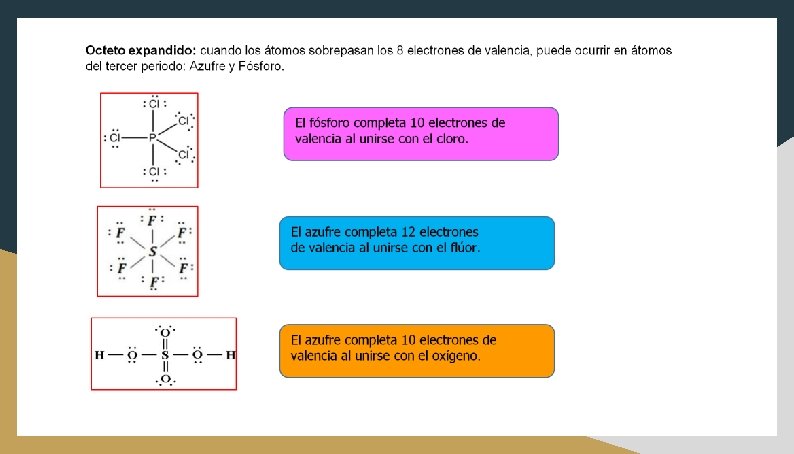
Excepciones a la regla del octeto


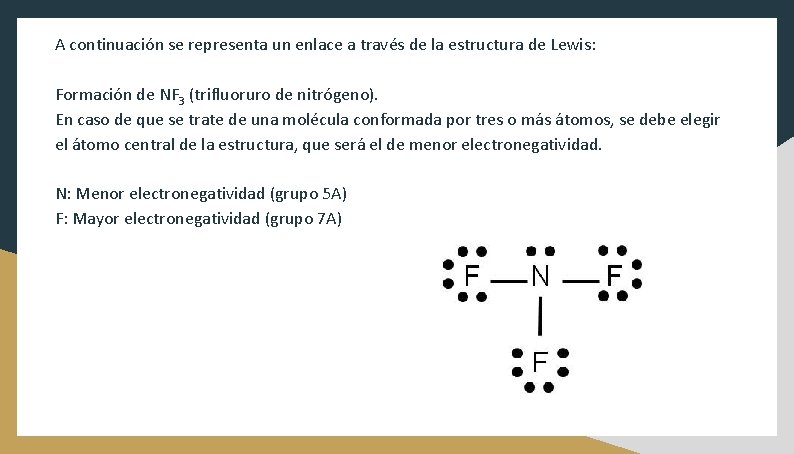
A continuación se representa un enlace a través de la estructura de Lewis: Formación de NF 3 (trifluoruro de nitrógeno). En caso de que se trate de una molécula conformada por tres o más átomos, se debe elegir el átomo central de la estructura, que será el de menor electronegatividad. N: Menor electronegatividad (grupo 5 A) F: Mayor electronegatividad (grupo 7 A)


Leyes de combinación Química. En una combinación o reacción química, nuevos compuestos o productos son formados por la combinación de dos o más reactivos. Este proceso involucra el rompimiento y la formación de enlaces. Para que esto suceda es necesario liberar o absorber energía. En el proceso de combinación se produce la formación de nuevos enlaces entre los átomos, que sólo pueden volver a ser separados mediante procedimientos químicos. Por ejemplo, si hacemos reaccionar cloro (Cl 2) e hidrógeno (H 2) en estado gaseoso y aplicamos energía al sistema (por ejemplo calor) para que se favorezca la formación de los productos, se produce la reacción de ambas moléculas formándose ácido clorhídrico HCl. Cl 2(g) + H 2(g) → HCl(l) Las combinaciones químicas se rigen por tres leyes fundamentales.

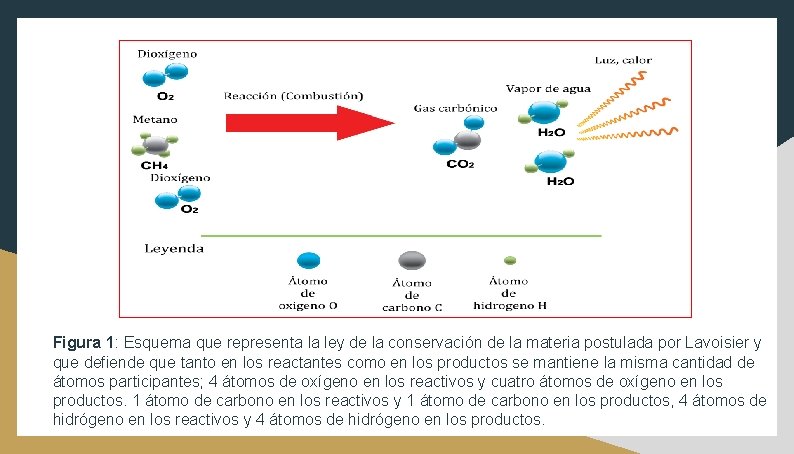
I. Ley de conservación de la materia de Lavoisier. Esta ley se puede definir de la siguiente manera: “En todas las reacciones químicas se cumple que la masa de los reactivos es igual a la masa obtenida en los productos”. Esta ley fue postulada por el químico francés Antoine Lavoisier cerca del año 1700, considerando las propiedades de los metales y su oxidación al ser quemados en presencia de aire en ambientes cerrados. Lavoisier fue capaz de demostrar que la masa que ganaba el metal al formar el óxido era igual a la masa perdida por el aire que lo rodeaba (Fig. 1).

Figura 1: Esquema que representa la ley de la conservación de la materia postulada por Lavoisier y que defiende que tanto en los reactantes como en los productos se mantiene la misma cantidad de átomos participantes; 4 átomos de oxígeno en los reactivos y cuatro átomos de oxígeno en los productos. 1 átomo de carbono en los reactivos y 1 átomo de carbono en los productos, 4 átomos de hidrógeno en los reactivos y 4 átomos de hidrógeno en los productos.

II. Ley de las proporciones definidas o ley de Proust. Esta ley fue establecida en el año 1801 por el químico francés Joseph Proust y postula que: 1. Al combinarse dos o más elementos para formar un nuevo compuesto, éstos se combinan en proporciones constantes de masa. Por ejemplo, para obtener agua, siempre se deben mezclar dos átomos de hidrógeno con uno de oxígeno. 2. Al separar los compuestos en sus elementos, las masas de estos se obtienen en proporciones constantes, sin importar su procedencia (natural o en el laboratorio). Esto siempre y cuando el compuesto sea puro(Fig. 2). Si continuamos analizando el ejemplo del agua, al descomponer una molécula de agua pura obtenida de cualquier fuente, obtenemos un 11, 2% de hidrógeno y un 88, 8% de oxígeno. Figura 2: Esquema de la ley de Proust para el caso del dióxido de carbono. Los gramos de carbono y los gramos de oxígeno están siempre en la proporción 3/8, independientemente del origen del dióxido de carbono.

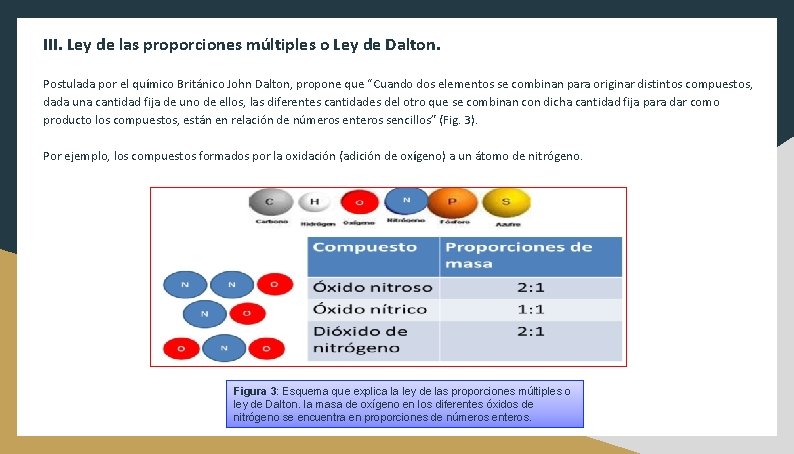
III. Ley de las proporciones múltiples o Ley de Dalton. Postulada por el químico Británico John Dalton, propone que “Cuando dos elementos se combinan para originar distintos compuestos, dada una cantidad fija de uno de ellos, las diferentes cantidades del otro que se combinan con dicha cantidad fija para dar como producto los compuestos, están en relación de números enteros sencillos” (Fig. 3). Por ejemplo, los compuestos formados por la oxidación (adición de oxígeno) a un átomo de nitrógeno. Figura 3: Esquema que explica la ley de las proporciones múltiples o ley de Dalton. la masa de oxígeno en los diferentes óxidos de nitrógeno se encuentra en proporciones de números enteros.

En síntesis Las reacciones químicas se rigen por tres leyes fundamentales: Lavoisier, Proust y Dalton. Según la primera, las masas de los reactantes y productos se mantienen constantes. La segunda postula que al combinarse dos o más elementos para formar un nuevo compuesto, estos lo hacen en proporciones constantes de masa. Por último, la tercera ley establece que cuando se combinan átomos para formar nuevas moléculas la relación entre sus masas siempre es un número entero.

2. Ley de Richter y de Gay-Lussac Si se dispone de medio litro de aceite de maravilla, se puede freír un pescado o cocinar muchas papas fritas. Tanto el pescado como las papas tienen propiedades y características diferentes pero en este caso tienen algo en común, fueron cocinados con la misma cantidad de aceite. Si este ejemplo cotidiano, lo explicamos científicamente se debe utilizar la ley de Richter de las proporciones recíprocas, la que postula que “las masas de diferentes elementos que se combinan con una misma masa de otro elemento dan la relación en que se combinarán entre sí, o bien múltiplos o submúltiplos de estas masas”. Por ejemplo:


Para gases, también es posible relacionar sus volumenes. En 1808, Gay-Lussac estableció la “ley de los volúmenes de combinación” que postula que “a una presión y temperatura dadas, los volúmenes de los gases que reaccionan entre sí se encuentran en relaciones de números enteros y sencillos”. Por ejemplo al reaccionar el hidrógeno gaseoso (H 2) con oxígeno gaseoso (O 2) para producir agua, puedes observar que se cumple la relación: doble volumen de hidrógeno que de oxígeno. Tal como se muestra a continuación:

Aplica 1. Para la formación del amoniaco (NH 3), se utiliza nitrógeno (N 2) e hidrógeno (H 2) según la siguiente reacción química: En esta reacción química se dispone de 66, 5 g de N 2 y 2 g de H 2, luego estos mismos 6, 5 g de N 2 reaccionan con 5 g de O 2, mediante la siguiente reacción: De acuerdo a la ley de las proporciones recíprocas ¿Cuántos g de O 2 reaccionarán con 8 g de H 2? A. 55 gramos de oxígeno B. 2020 gramos de oxígeno C. 1818 gramos de oxígeno D. 2222 gramos de oxígeno

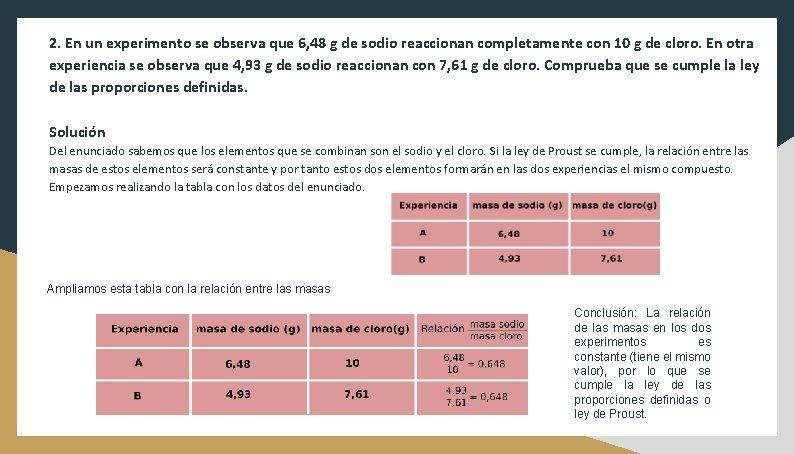
2. En un experimento se observa que 6, 48 g de sodio reaccionan completamente con 10 g de cloro. En otra experiencia se observa que 4, 93 g de sodio reaccionan con 7, 61 g de cloro. Comprueba que se cumple la ley de las proporciones definidas. Solución Del enunciado sabemos que los elementos que se combinan son el sodio y el cloro. Si la ley de Proust se cumple, la relación entre las masas de estos elementos será constante y por tanto estos dos elementos formarán en las dos experiencias el mismo compuesto. Empezamos realizando la tabla con los datos del enunciado. Ampliamos esta tabla con la relación entre las masas Conclusión: La relación de las masas en los dos experimentos es constante (tiene el mismo valor), por lo que se cumple la ley de las proporciones definidas o ley de Proust.