ESTEQUIOMETRA Leyes Ponderales Se refieren a las masas















- Slides: 20

ESTEQUIOMETRÍA Leyes Ponderales

Se refieren a las masas de las sustancias que entran en juego en las reacciones químicas. O LEY DE CONSERVACIÓN DE LA MASA O LEY DE LAS PROPORCIONES DEFINIDAS O LEY DE LAS PROPORCIONES MÚLTIPLES O LEY DE LAS PROPORCIONES RECÍPROCAS

LEY DE LAVOISSIER O LEY DE CONSERVACIÓN DE LA MASA O En toda reacción química ordinaria, la suma de las masas de las sustancias reaccionantes es igual a la suma de las masas de sus productos.

O

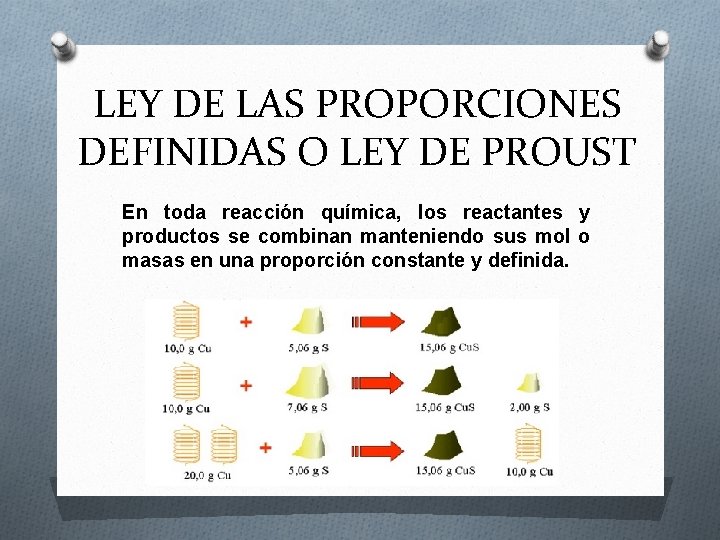
LEY DE LAS PROPORCIONES DEFINIDAS O LEY DE PROUST En toda reacción química, los reactantes y productos se combinan manteniendo sus mol o masas en una proporción constante y definida.

1 mol + 2 mol 5 mol + 10 mol 98 g + 80 g 196 g + 160 g Ejercicio: Nos encontramos en el laboratorio dos muestras de oxido de calcio. Comprobar si se cumple con la Ley de Proust Muestra 1 Muestra 2 1. 004 g Calcio 2. 209 g Calcio 0. 4 g Oxígeno 0. 88 g Oxígeno

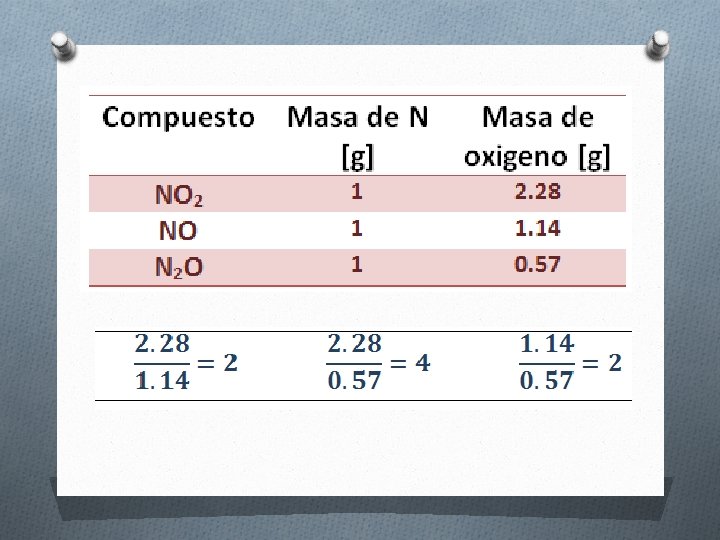
LEY DE DALTON O LEY DE LAS PROPORCIONES MULTIPLES O Cuando dos elementos se combinan entre si para formar compuestos diferentes, las diferentes masas de uno de ellos que se combina con una masa fija de otro, guardan entre si una relación de números enteros sencillos.


LEY DE RICHTER O LEY DE LAS PROPORCIONES RECÍPROCAS O Las masas de diferentes elementos que se combinan con una misma masa de otro elemento dan la relación en que se combinarán entre sí o bien múltiplos o submúltiplos de estas masas. O Ca. O 40 g Ca + 16 g O O Ca. S 40 g Ca + 32 g S O ¿SO?

COCEPTO DE MOL


MOL

¿QUE ES UN MOL? O Es un cierto número de: O Atomos O Moleculas O Iones

Moles: montón o pila O Wilhem Ostwald

O O 1969: Se aprobó el mol como una unidad de medida del SI.

MASA ATOMICA

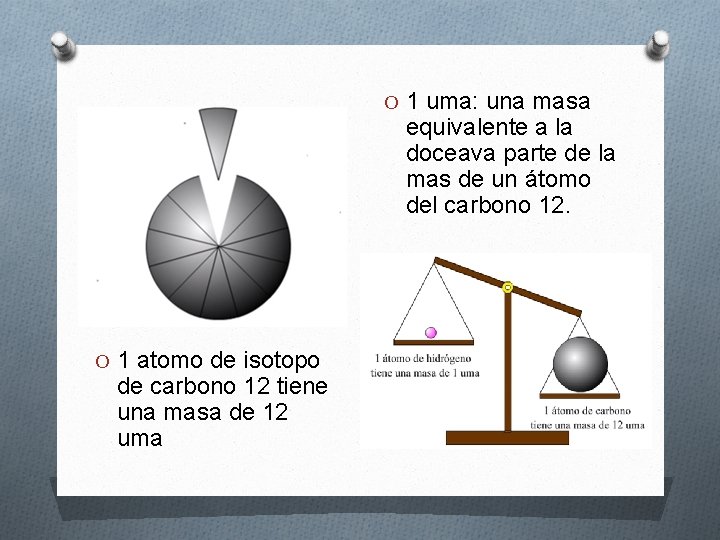
O 1 uma: una masa equivalente a la doceava parte de la mas de un átomo del carbono 12. O 1 atomo de isotopo de carbono 12 tiene una masa de 12 uma

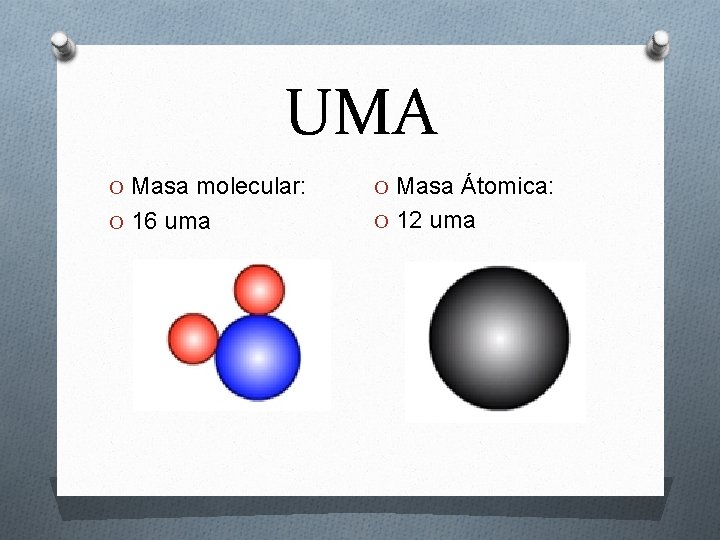
UMA O Masa molecular: O Masa Átomica: O 16 uma O 12 uma

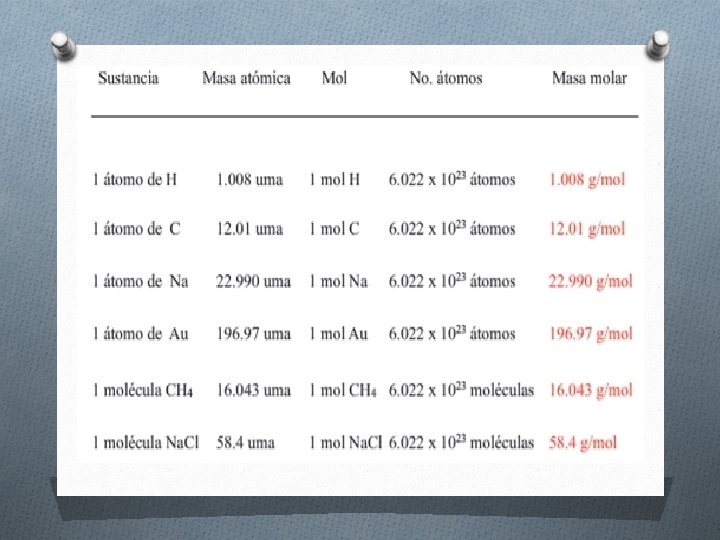
MASA MOLAR O Es la masa de 1 mol O de dicha sustancia expresada en gramos. O Sus unidades de medición son gramos sobre mol (g/mol)

 Leyes ponderales ejercicios
Leyes ponderales ejercicios Leyes ponderales
Leyes ponderales Leyes ponderales
Leyes ponderales Estequiometra
Estequiometra Estequiometra
Estequiometra 20000x160
20000x160 Dinámica de las masas fluidas
Dinámica de las masas fluidas El desprecio de las masas
El desprecio de las masas Aplicaciones de la espectrometría de masas
Aplicaciones de la espectrometría de masas Estructura de la argumentacion
Estructura de la argumentacion Etilbenceno masa molar
Etilbenceno masa molar Argumento emotivo-afectivo
Argumento emotivo-afectivo Ejemplos de argumentos por experiencia personal
Ejemplos de argumentos por experiencia personal Cultura de masas imagenes
Cultura de masas imagenes Cisterna selar
Cisterna selar Problemas sociales
Problemas sociales Dos masas
Dos masas Cuerpos vinculados
Cuerpos vinculados Masas
Masas Argumento fetichismo de masas
Argumento fetichismo de masas Atriebes dieviete romiešu mitoloģijā
Atriebes dieviete romiešu mitoloģijā