Le dosage volumtrique Anne COLIN Lyce Jean Perrin





- Slides: 11

Le dosage volumétrique Anne COLIN Lycée Jean Perrin (Rezé)

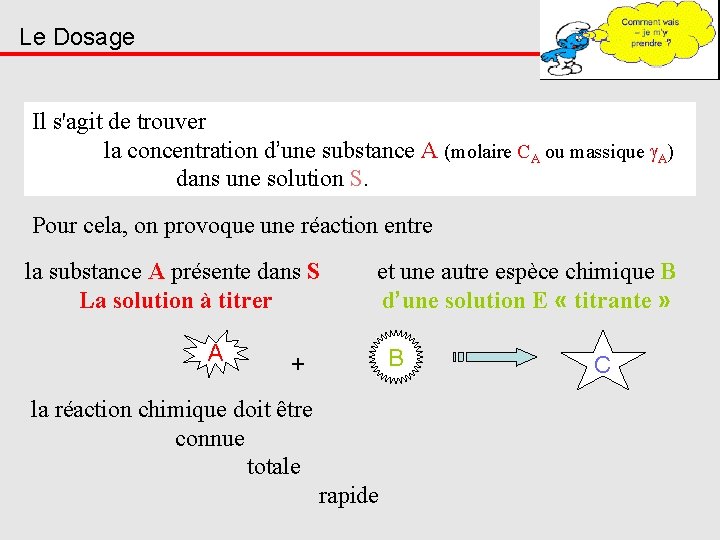
Le Dosage Il s'agit de trouver la concentration d’une substance A (molaire CA ou massique A) dans une solution S. Pour cela, on provoque une réaction entre la substance A présente dans S La solution à titrer A et une autre espèce chimique B d’une solution E « titrante » B + la réaction chimique doit être connue totale rapide C

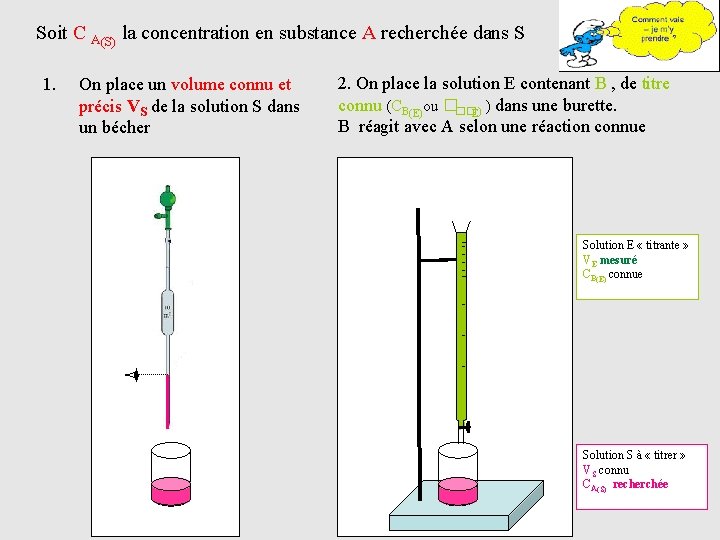
Soit C A(S) la concentration en substance A recherchée dans S 1. On place un volume connu et précis VS de la solution S dans un bécher 2. On place la solution E contenant B , de titre connu (CB(E)ou ���E) ) dans une burette. B réagit avec A selon une réaction connue Solution E « titrante » VE mesuré CB(E) connue Solution S à « titrer » VS connu CA(S) recherchée

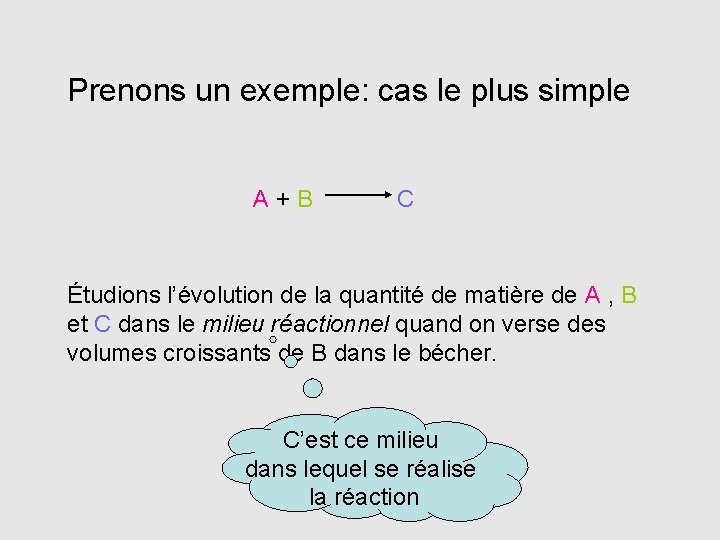
Prenons un exemple: cas le plus simple A+B C Étudions l’évolution de la quantité de matière de A , B et C dans le milieu réactionnel quand on verse des volumes croissants de B dans le bécher. C’est ce milieu dans lequel se réalise la réaction

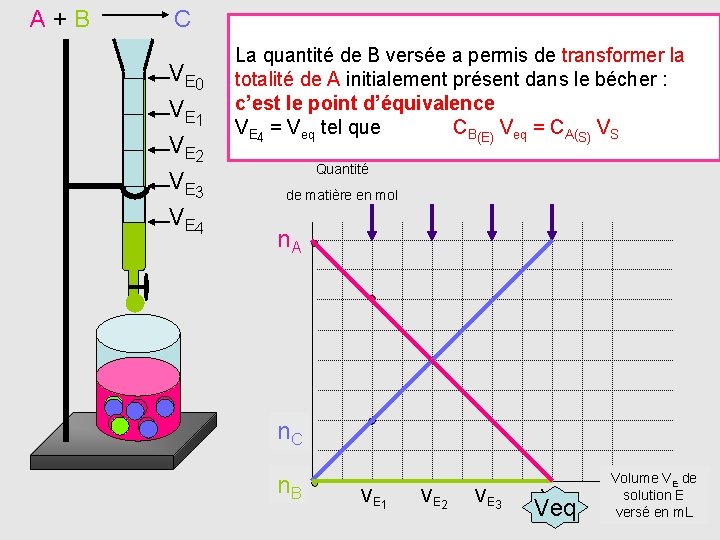
A+B C V E 0 V E 1 V E 2 V E 3 V E 4 Le composé B réagit totalement A en formant C On constate que la diminution deavec n est bien linéaire La quantité de B rien versée a permis de. A transformer Lorsque n’est versé dans le becher la donc n. B = 0 mole ! en fonction de VV E =0 m. L totalité de A initialement présentdedans le bécher : B E reportons les variations quantité de A, La quantité de B versée est n = C V n VS - Cde VC versons nouveau la. B solution B(E) titrante E 1 A = CA(S) B E 2 c’est le point d’équivalence n(E) = V A A S et n. C (S) sur un La quantité de C formée est n. C graphe, = V 1 n croit linéairement, = C VEC (E) EV C C B VE 4 = Veq tel que CB(E)(E)Veq =2 BC A(S) - SC La quantité de A consommé restant est ndonc B est totalement 0 Smole A = Cn. AB(S)=V B(E) VE 1 Quantité de matière en mol n. A n. C n. B VE 1 VE 2 VE 3 VE 4 Veq Volume VE de solution E versé en m. L

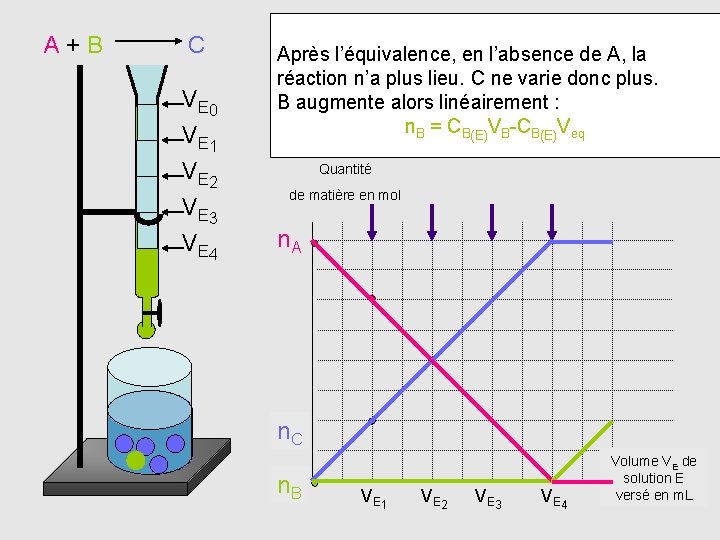
A+B C V E 0 V E 1 V E 2 V E 3 V E 4 Après l’équivalence, en l’absence de A, la réaction n’a plus lieu. C ne varie donc plus. B augmente alors linéairement : n. B = CB(E)VB-CB(E)Veq Quantité de matière en mol n. A n. C n. B VE 1 VE 2 VE 3 VE 4 Volume VE de solution E versé en m. L

Grâce à la détermination expérimentalement du point d’équivalence Moment où A a été totalement consommé par la réaction. puis à la mesure de Veq, Le résultat expérimental est un volume, on a donc bien un dosage volumétrique on en déduit la quantité de A présente dans la solution S en effectuant un bilan de matière sur la réaction du dosage entre A et B

Détermination du point d’équivalence • La détermination de Veq est simple si le contenu du bécher change de couleur au point d’équivalence C’est ce que l’on observe parfois lorsque A, B et C sont de couleur différente • Plus fréquemment, l’équivalence sera repérée par divers moyens – indicateurs colorés : molécules qui changent de couleur au point d’équivalence – p. H-mètre,

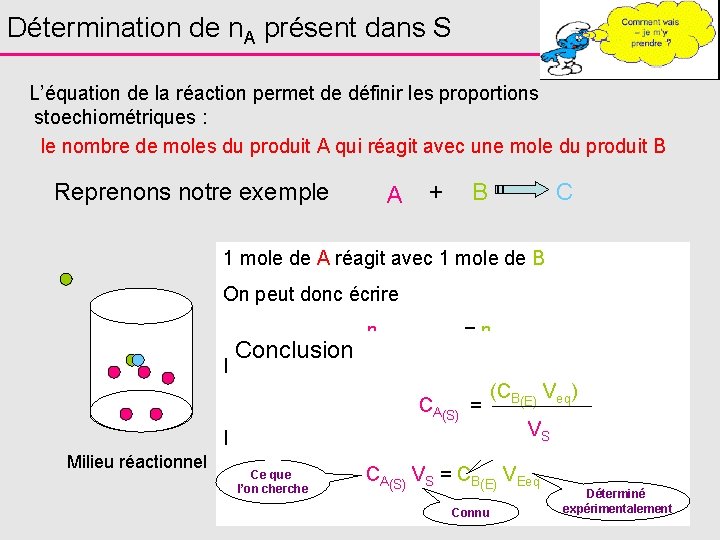
Détermination de n. A présent dans S L’équation de la réaction permet de définir les proportions stoechiométriques : le nombre de moles du produit A qui réagit avec une mole du produit B Reprenons notre exemple A + B C 1 mole de A réagit avec 1 mole de B On peut donc écrire Conclusion n. A ayant réagi = n. B versé Donc à l’équivalence, lorsque tout A a réagi (CB(E) Veq) n. A initialement présent dans = n CA(S)S = B versé à l’équivalence V Connu S D’où Milieu réactionnel Ce que l’on cherche CA(S) VS = CB(E) VEeq Connu Déterminé expérimentalement

Compliquons la situation … Prenons un deuxième exemple A + 2 B C 1 mole de A réagit avec 2 mole de B 2 fois moins de A ont réagi que de B versé On peut donc écrire n. A ayant réagi = 1/2 n. B versé Donc à l’équivalence, lorsque tout A a réagi n. A initialement présent dans S = 1/2 n. B versé à l’équivalence D’où Connu Conclusion Ce que l’on cherche Connu CA(S) VS = 1/2 (CB(E) Veeq)1 CA(S) = 2 (CB(E) Veq) VS Déterminé expérimentalement

Généralisons …. x. A+ y. B z. C A l’équivalence, on peut alors écrire l’équation suivante n. A initialement présent dans S = x n. B versé à l’équivalence y D’où Conclusion x (CB(E) Veq) CA(S) = y VS




















