La crisi del Modello planetario Il modello planetario








- Slides: 14

La crisi del Modello planetario

Il modello planetario di Rutherford era molto più credibile di quello di Thomson, ma ancora non soddisfaceva gli scienziati. Il fatto che l’elettrone si trovi fuori dal nucleo, anche a notevoli distanze, per non precipitarvi deve possedere una certa energia che gli permette di orbitare in modo da creare una forza centrifuga da contrapporre a quella elettromagnetica da parte del nucleo. Vari fisici nel XIX secolo (in particolare Maxwell) avevano dimostrato, però, che una qualsiasi carica elettrica in moto accelerato (non rettilineo uniforme) genera onde elettromagnetiche (come radioonde, microonde, infrarossi, colori del visibile, ultravioletti ecc. ) a spese di energia. Questo è escluso per un pianeta in quanto non ha carica elettrica.

I segnali elettromagnetici

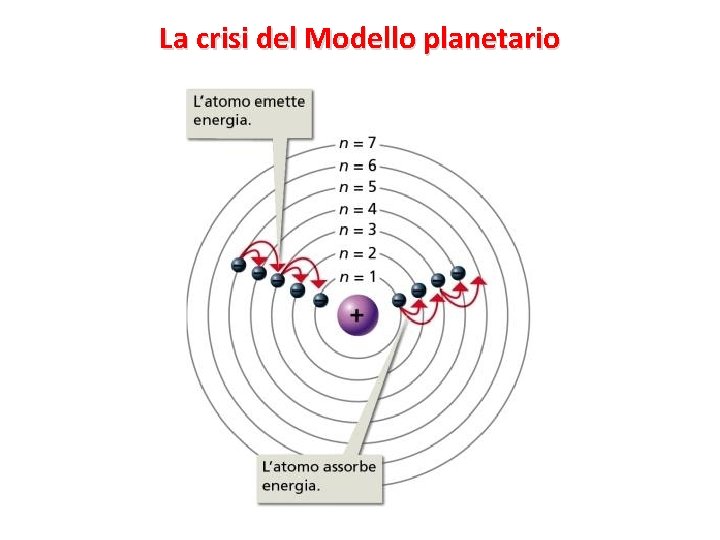
Nel modello planetario una carica elettrica, l’elettrone, ha un moto accelerato (accelerazione centripeta). L’elettrone, quindi, dovrebbe costantemente emettere segnali elettromagnetici a spese di energia, la sua energia Perdendo energia, l’everrebbe gradualmente attratto dal nucleo fino a precipitarvi (teoria dell’annichilimento). Di fatto, perciò, il modello planetario non starebbe in piedi… Ma l’esperimento dell’α-scattering dimostrava fortemente che il modello planetario era l’unico possibile. Gli scienziati erano davvero in crisi. Come superare questa crisi?

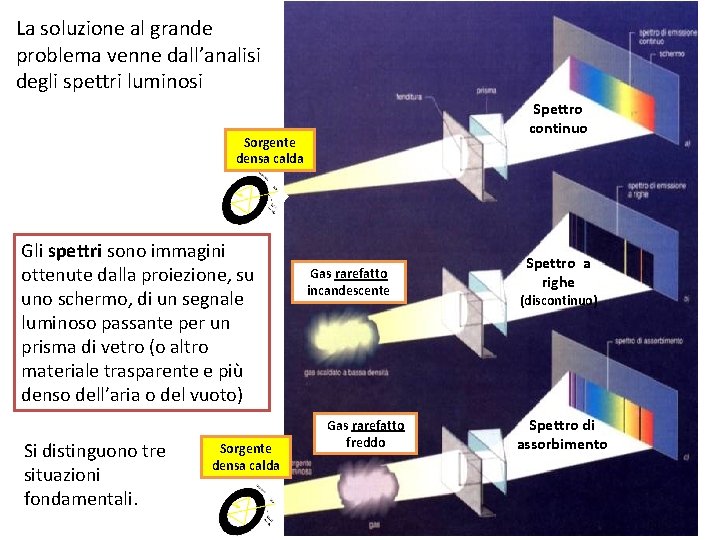
La soluzione al grande problema venne dall’analisi degli spettri luminosi Spettro continuo Sorgente densa calda Gli spettri sono immagini ottenute dalla proiezione, su uno schermo, di un segnale luminoso passante per un prisma di vetro (o altro materiale trasparente e più denso dell’aria o del vuoto) Si distinguono tre situazioni fondamentali. Sorgente densa calda Gas rarefatto incandescente Gas rarefatto freddo Spettro a righe (discontinuo) Spettro di assorbimento


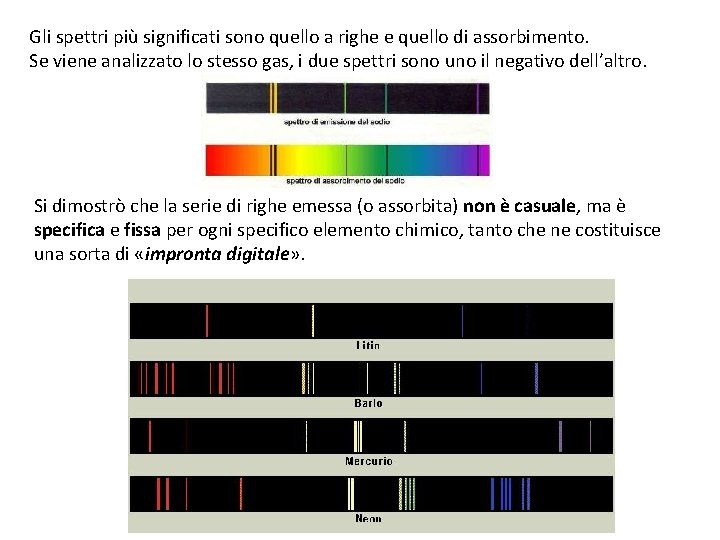
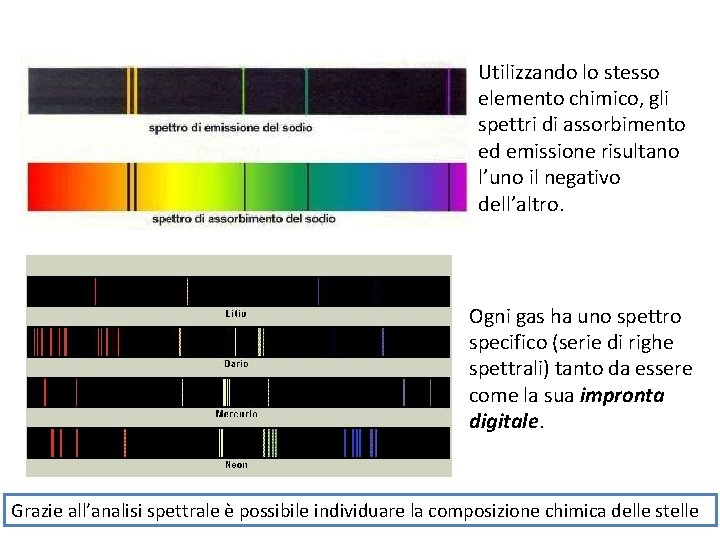
Gli spettri più significati sono quello a righe e quello di assorbimento. Se viene analizzato lo stesso gas, i due spettri sono uno il negativo dell’altro. Si dimostrò che la serie di righe emessa (o assorbita) non è casuale, ma è specifica e fissa per ogni specifico elemento chimico, tanto che ne costituisce una sorta di «impronta digitale» .

Utilizzando lo stesso elemento chimico, gli spettri di assorbimento ed emissione risultano l’uno il negativo dell’altro. Ogni gas ha uno spettro specifico (serie di righe spettrali) tanto da essere come la sua impronta digitale. Grazie all’analisi spettrale è possibile individuare la composizione chimica delle stelle

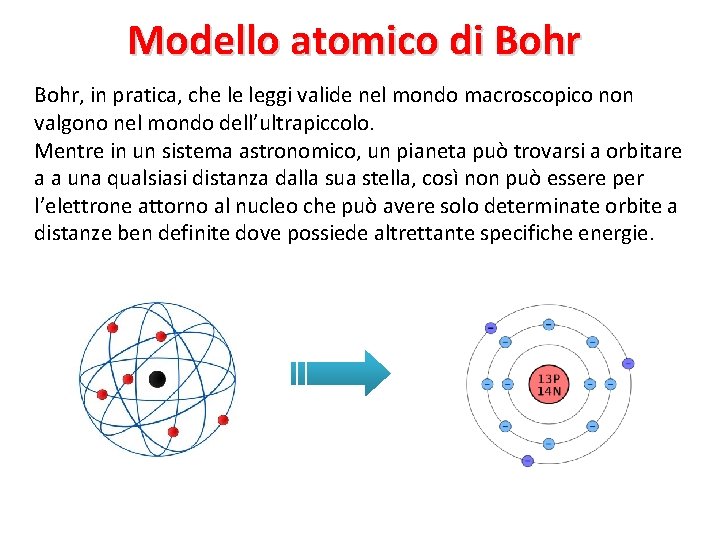
Ritornando all’atomo, Rutherford non sapeva spiegare. . . Ø Ø Perché l’elettrone potesse orbitare attorno al nucleo senza perdere energia, Perché la luce emessa o assorbita da un gas rarefatto (quindi dagli atomi) sia discontinua (cioè avesse solo determinati colori). Fondamentali contributi alla soluzione di questi problemi si devono a Bohr che si avvalse delle scoperte di Planck ed Einstein.

Modello atomico di Bohr, in pratica, che le leggi valide nel mondo macroscopico non valgono nel mondo dell’ultrapiccolo. Mentre in un sistema astronomico, un pianeta può trovarsi a orbitare a a una qualsiasi distanza dalla sua stella, così non può essere per l’elettrone attorno al nucleo che può avere solo determinate orbite a distanze ben definite dove possiede altrettante specifiche energie.

Postulati di Bohr (1913)

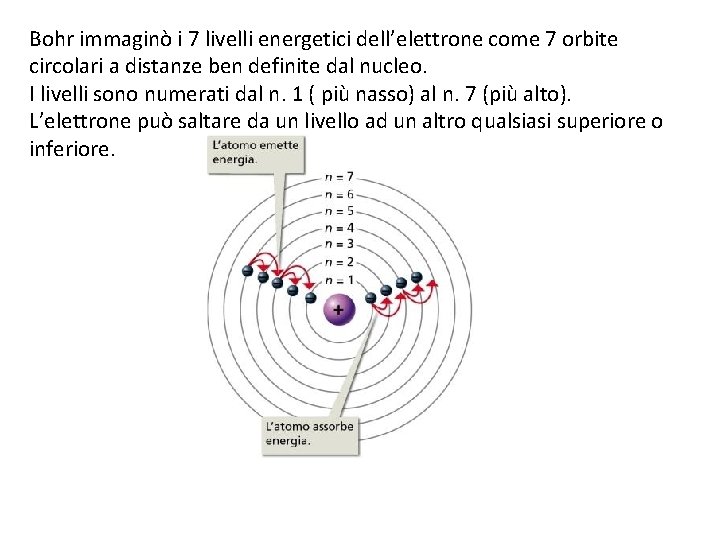
Bohr studiò molto bene l’atomo di idrogeno H individuando 7 livelli energetici per il suo elettrone. Tali livelli corrisponderebbero a specifiche orbite circolari Quando si dà energia ad un atomo (ad esempio bruciando la sostanza di cui fa parte) i suoi elettroni assorbono parte di tale energia e la utilizzano per allontanarsi dal nucleo saltando su un livello energetico più alto (spettro di assorbimento). Gli elettroni si trovano, così, in uno stato eccitato Questa situazione rende molto instabile l’atomo perciò, in un attimo, gli elettroni tornano al loro livello originario facendo un salto inverso. In questo modo cedono la stessa quantità di energia precedentemente assorbita. Tale energia è ceduta sotto forma di segnali elettromagnetici di determinati colori: sono i colori dello spettro di emissione a righe. I salti fatti dagli elettroni sono detti salti quantici


Bohr immaginò i 7 livelli energetici dell’elettrone come 7 orbite circolari a distanze ben definite dal nucleo. I livelli sono numerati dal n. 1 ( più nasso) al n. 7 (più alto). L’elettrone può saltare da un livello ad un altro qualsiasi superiore o inferiore.
 Crisi demografica del 600
Crisi demografica del 600 La crisi del mondo arabo
La crisi del mondo arabo La crisi del 29
La crisi del 29 Il seicento schema
Il seicento schema Crisi del rinascimento
Crisi del rinascimento Kin maya 13 lunas
Kin maya 13 lunas Tren epicicloidal tipo wilson
Tren epicicloidal tipo wilson Astro luminoso centro de nuestro sistema planetario
Astro luminoso centro de nuestro sistema planetario Modelo planetario geocéntrico
Modelo planetario geocéntrico Optimates e populares
Optimates e populares Crisi delle certezze nietzsche
Crisi delle certezze nietzsche Cholinergic crisis
Cholinergic crisis Narrativa della crisi
Narrativa della crisi Crisi fisica classica
Crisi fisica classica Captopril sublinguale crisi ipertensiva
Captopril sublinguale crisi ipertensiva