KHHH Al NTK 27 I V tr v











- Slides: 12



KHHH : Al NTK : 27 I. Vị trí và cấu tạo: 1. Vị trí của nhôm trong bảng tuần hoàn: Al( Z=13) : 1 s 22 p 63 s 23 p 1 Vị trí: chu kì 3, nhóm IIIA Trong chu kì Al đưng sau Mg, trước Si Trong nhóm IIIA: Al đưng sau B. 2. Cấu tạo của nhôm: Là nguyên tố p, có 3 e hoá trị. Xu hướng nhường 3 e tạo ion Al 3+ + 3 e [Ne]3 s 23 p 1 [Ne] Trong hợp chất nhôm có số oxi hoá +3 vd: Al 2 O 3, Al. Cl 3 Cấu tạo đơn chất : Lập phương tâm diện

II. Tính chất vật lí của nhôm (SGK) KHHH : Al NTK : 27 III. Tính chất hoá học Eo. Al 3+/Al = -1, 66 V; I 1, I 2, I 3 thấp Al là kim loại có tính khử mạnh 1. Tác dụng với phi kim a. Tác dụng với halogen Vd: 2 Al + 3 Cl 2 2 Al. Cl 3 b. Tác dụng với oxi Vd: 4 Al + 3 O 2 2 Al 2 O 3

2. Tác dụng với axit: KHHH : Al NTK : 27 a. Với các dung dịch axit HCl, H 2 SO 4 loãng Vd: 2 Al + 6 HCl 2 Al. Cl 3 + 3 H 2 2 Al + 3 H 2 SO 4 Al 2(SO 4)3 + 3 H 2 Pt ion: 2 Al + 6 H+ 2 Al 3+ + 3 H 2 Al khử ion H+ trong dung dịch axit thành hidro tự do.

KHHH : Al NTK : 27 b. Với dung dịch HNO 3, H 2 SO 4 đặc * Al không pư với HNO 3 đặc nguội, H 2 SO 4 đặc nguội. * Với các axit HNO 3 đặc nóng, HNO 3 loãng, H 2 SO 4 đặc nóng: Al khử được N+5 và S+6 xuống những mức oxi hoá thấp hơn. Vd: Al + 6 HNO 3 đ Al(NO 3)3 + 3 NO 2 + 3 H 2 O 2 Al + 6 H 2 SO 4 đ Al 2(SO 4)3 + 3 SO 2 + 6 H 2 O Al + HNO 3 N 2 + ?

KHHH : Al NTK : 27 3. Tác dụng với oxit kim loại: Ở nhiệt độ cao, Al khử được nhiều ion kim loại kém hoạt động hơn trong oxit ( Fe. O, Cu. O, . . . ) thành kim loại tự do. Vd: Fe 2 O 3 + 2 Al 2 O 3 + 2 Fe Al + Cu. O ? phản ứng nhiệt nhôm.

4. Tác dụng với H 2 O: o Do Eo. Al 3+/Al < Eo H 2 O/H 2 Al khử được nước. o 2 Al + 6 H 2 O 2 Al(OH)3 + 3 H 2 o phản ứng dừng lại nhanh vì có lớp Al(OH)3 không tan trong H 2 O bảo vệ lớp nhôm bên trong. 5. Tác dụng với bazơ: o o Nhôm tác dụng với dung dịch bazơ mạnh: Na. OH, KOH, Ca(OH)2. . Vd: 2 Al +2 Na. OH +6 H 2 O 2 Na[Al(OH)4] +3 H 2 natri aluminat o Hoặc 2 Al +2 Na. OH +2 H 2 O 2 Na. Al. O 2 +3 H 2 o Al +Ba(OH)2 + H 2 O ?

IV. Ứng dụng và trạng thái tự nhiên: 1. Ứng Dụng. (SGK) 2. Trạng thái tự nhiên (SGK) V. Sản xuất nhôm: 1. Nguyên liệu: Nguyên liệu là quặng boxit Al 2 O 3. 2 H 2 O 2. Điện phân nhôm oxit nóng chảy. Qua 2 công đoạn + Công đoạn tinh chế quặng boxit + Công đoạn đpnc Al 2 O 3 Để hạ nhiệt độ nóng chảy của Al 2 O 3 từ 2050 o C xuống 900 o. C, hoà tan Al 2 O 3 trong criolit ptđp: Al 2 O 3 oĐpnc, xt 2 Al + 3/2 O 2

Áp dụng Tuỳ theo nồng độ của HNO 3 và nhôm có thể khử HNO 3 thành NO 2. NO, N 2 hoặc NH 4 NO 3. Viết các phản ứng xảy ra. +5 0 6 HNO 3 + Al +5 0 4 HNO 3 + +5 Al(NO 3)3 + 3 NO 2 +3 H 2 O +2 +3 Al 0 +4 +3 + NO + 2 H 2 O Al(NO 3)3 0 +3 30 HNO 3 + 8 Al(NO 3)3 + 3 N 2 +15 H 2 O +5 0 +3 -3 30 HNO 3 + 8 Al(NO 3)3 + 3 NH 4 NO 3 + 9 H 2 O

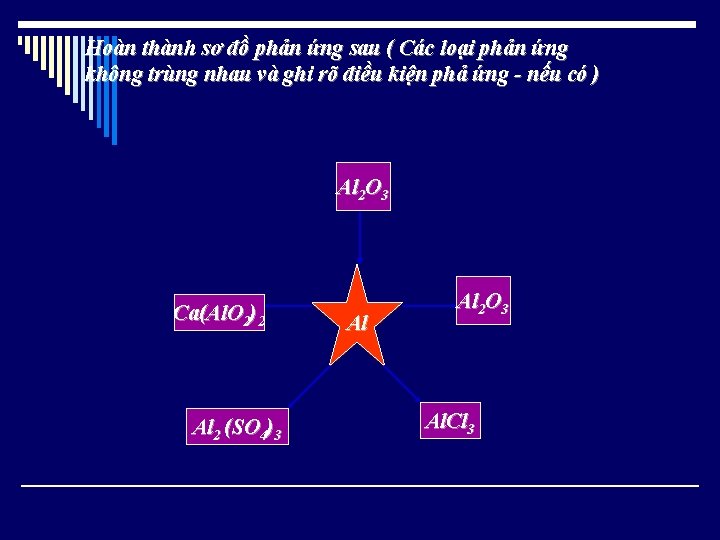
Hoàn thành sơ đồ phản ứng sau ( Các loại phản ứng không trùng nhau và ghi rõ điều kiện phả ứng - nếu có ) Al 2 O 3 Ca(Al. O 2)2 Al 2 (SO 4)3 Al Al 2 O 3 Al. Cl 3

LÝ thuyÕt: - Học thuộc tính chất vật lý , tính chất hoá học của nhôm , viết PTHH minh hoạ và biết vận dụng vào thực tế : cách sử dụng các dụng cụ làm bằng nhôm - Viết phương trình điện phân nóng chảy Al 2 O 3 Bµi tËp: 2, 3, 4, 5, 6 /57. SGK HD bµi 6: -Viết 3 PTHH ( Mg không phản ứng với dung dịch Na. OH) --> m. Mg. O = 0, 6 gam -> n. Mg. O = 0, 6/24 = 0, 025 mol = n. H 2 (ở phản ứng 2 ) n. H 2 ở phản ứng 1 n. Al Chuẩn bị bài mới : Đọc trước ở nhà Bài Sắt