Istituto Comprensivo Muro Leccese Scuola Secondaria Palmariggi I







- Slides: 11

Istituto Comprensivo Muro Leccese Scuola Secondaria Palmariggi I CRISTALLI IONICI Classe 2 A - a. s. 2008 -2009 Docente: Michelina Occhioni

CRISTALLI IONICI I cristalli ionici sono sali derivati dall’unione di elementi con alta differenza di elettronegatività (formazione del legame ionico - es. sale da cucina)

CRISTALLI IONICI • In un cristallo ionico gli ioni di segno opposto sono legati mediante forze “elettriche” • Non esiste quindi una molecola singola di Na. Cl, costituita da 2 atomi, ma un intero cristallo.

IL SALE DA CUCINA Il sale da cucina (Cloruro di Sodio Na. Cl) è un cristallo a forma di cubo in cui gli ioni positivi (Na+) sono vicini agli ioni negativi (Cl-) Cl- Na+

PROPRIETÀ DEI CRISTALLI IONICI I cristalli ionici sono: • SOLUBILI IN ACQUA • ISOLANTI A BASSA TEMPERATURA • BUONI CONDUTTORI ALLO STATO FUSO • DURI (cioè si intaccano o si scalfiscono difficilmente) • FRAGILI (cioè si rompono facilmente)

FRAGILITÀ Perché i cristalli ionici si rompono facilmente?

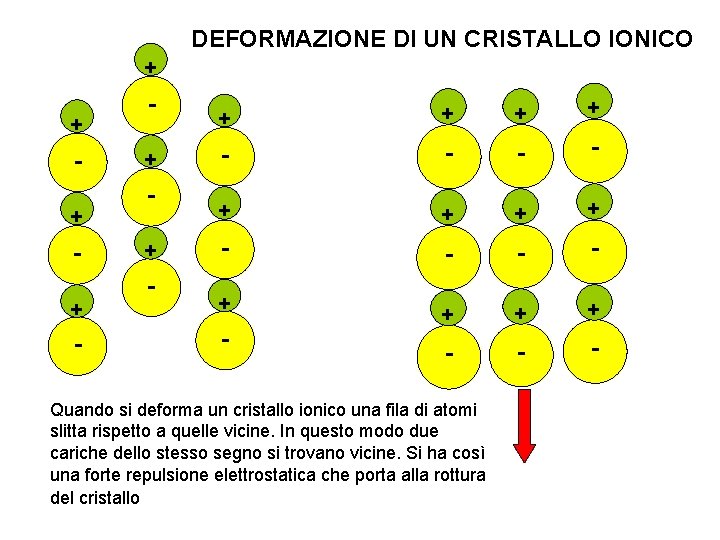
DEFORMAZIONE DI UN CRISTALLO IONICO + + - + + + + - - + - + + + - - - Quando si deforma un cristallo ionico una fila di atomi slitta rispetto a quelle vicine. In questo modo due cariche dello stesso segno si trovano vicine. Si ha così una forte repulsione elettrostatica che porta alla rottura del cristallo

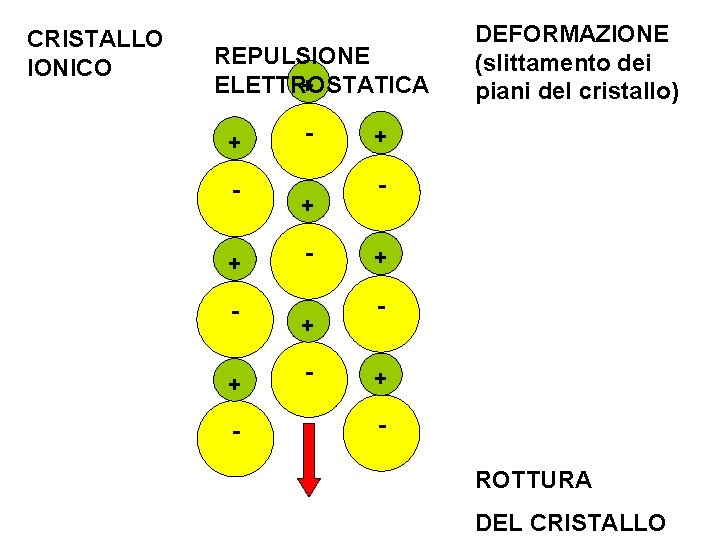
CRISTALLO IONICO REPULSIONE ELETTROSTATICA + + - DEFORMAZIONE (slittamento dei piani del cristallo) + + + ROTTURA DEL CRISTALLO

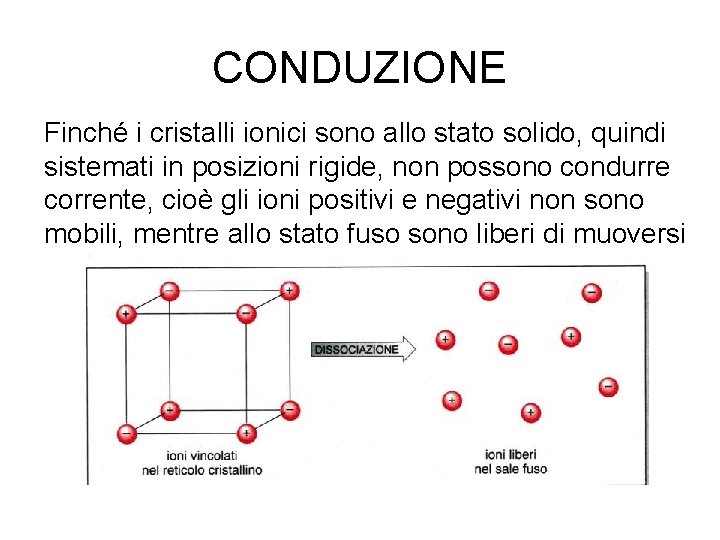
CONDUZIONE Finché i cristalli ionici sono allo stato solido, quindi sistemati in posizioni rigide, non possono condurre corrente, cioè gli ioni positivi e negativi non sono mobili, mentre allo stato fuso sono liberi di muoversi

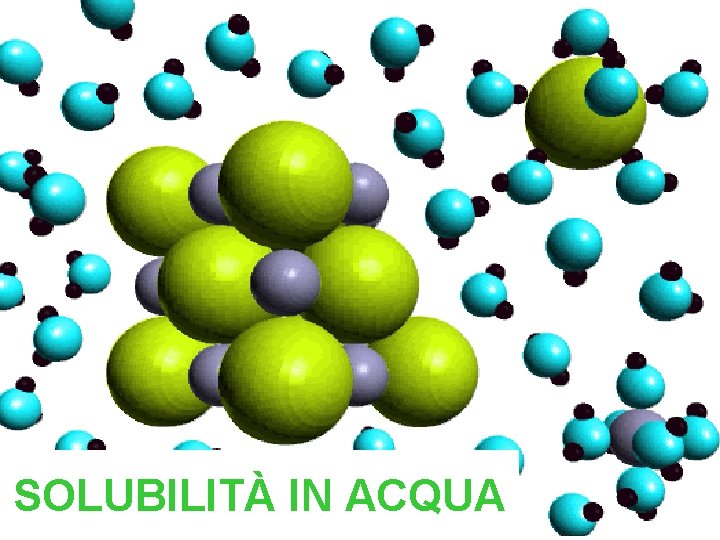
SOLUBILITÀ IN ACQUA

L’acqua è polare, cioè ha una zona in parte positiva e una zona in parte negativa. Il Sale è formato da particelle positive e da particelle negative (ioni). La parte positiva dell’acqua circonda gli ioni negativi del sale (Cl-). La parte negativa dell’acqua circonda gli ioni positivi del sale (Na+). Così il cristallo si sgretola nell’acqua e non si vede più perché gli ioni da soli sono troppo piccoli per essere visti ad occhio nudo.
 Comprensivomuro
Comprensivomuro Istituto comprensivo di chignolo po
Istituto comprensivo di chignolo po Ic bocchi parma
Ic bocchi parma Ic muro leccese
Ic muro leccese Muro ala e muro testa
Muro ala e muro testa Griglia di osservazione cooperative learning
Griglia di osservazione cooperative learning Scuola secondaria di primo grado pavoncelli cerignola
Scuola secondaria di primo grado pavoncelli cerignola Ic calenzano
Ic calenzano Scuola alberto sordi
Scuola alberto sordi Griglie di osservazione sostegno scuola secondaria
Griglie di osservazione sostegno scuola secondaria Competenze educazione fisica scuola secondaria primo grado
Competenze educazione fisica scuola secondaria primo grado Premode
Premode


















