Importance de leau pour les tres vivants Polarit










- Slides: 18

Importance de l’eau pour les êtres vivants Polarité de l’eau Les molécules d’eau sont formées de deux atomes d’hydrogène et un atome d’oxygène. (H 2 O) covalente Les molécules d’eau sont polaires : l’oxygène est partiellement négatif et l’hydrogène est partiellement positif. hydrogène Les liaisons covalente polaires relient H et O à l’intérieur d’une même molécule. Les liaisons hydrogène sont une attraction entre l’ oxygène (-) d’une molécule et l’hydrogène (+) d’une molécule voisine. (Pointillé rouge)

Propriétés extraordinaires de l’eau qui résultent de sa polarité Pouvoir de cohésion Contrairement aux autres petites molécules, l’eau est à l’état liquide à la température ambiante en raison de la forte attraction entre les molécules (dû aux liaisons hydrogène). Capillarité: l’eau monte dans les tubes microscopiques des Exemple: plantes, ou circule dans les capillaires sanguins. Chaleur massique élevée L’eau nécessite beaucoup d’énergie pour se réchauffer ou se refroidir, procurant un milieu thermique stable pour les êtres vivants. Les organismes sont composés d’un grand % d’eau. Plusieurs Exemple: vivent dans l’eau. La température du corps ou l’environnement ne subissent pas de changements rapides. Chaleur de vaporisation élevée La transformation de l’eau en vapeur nécessite beaucoup d’énergie, réduisant la déshydratation des êtres vivants. Exemple: Un peu de transpiration permet une grande élimination d’énergie.

Propriétés extraordinaires de l’eau qui résultent de sa polarité Dilatation une fois gelé L’eau est la seule substance pure à augmenter son volume quand elle passe à l’état solide. (La glace flotte sur l’eau. ) Exemple: Les animaux marins peuvent vivre dans l’eau sous la glace pendant l’hiver et avoir accès au fond pour se nourrir. Solvant important Elle dissout la plupart des substances qui jouent un rôle dans les processus vitaux: sel, oxygène, dioxyde de carbone, glucose, acides aminés. Exemple: Le sang et la sève transportent les nutriments et l’oxygène aux parties de la plante qui en ont besoin, et servent de véhicule aux déchets (CO 2, urée…)

Les composés organiques Notions relatives à la chimie organique Composé inorganique : ne possède pas de carbone. ex. : eau, acide, sels, etc. Composé organique : composé à base de carbone (C) habituellement associé en chaines et relié à des atomes d’hydrogène. ex. : C 6 H 12 O 6 (sucre), CH 4, C 3 H 8… (mais pas CO 2) Chaque atome de carbone peut former 4 liaisons avec d’autres atomes. Quatre (4) catégories de composés organiques essentiels à la vie : a) glucides b) lipides c) protéines d) acides nucléiques

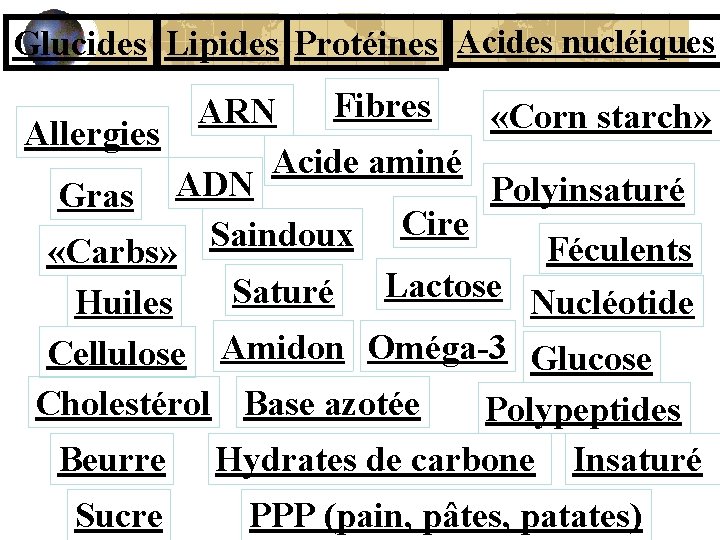
Glucides Lipides Protéines Acides nucléiques Fibres ARN «Corn starch» Allergies Acide aminé Polyinsaturé Gras ADN Cire Saindoux Féculents «Carbs» Lactose Saturé Huiles Nucléotide Cellulose Amidon Oméga-3 Glucose Cholestérol Base azotée Polypeptides Beurre Hydrates de carbone Insaturé Sucre PPP (pain, pâtes, patates)

Monomères et Polymères Monomère Monomère Polymère

Monomères et polymères Certains composés sont formés des regroupement de particules similaires appelées monomères. Ex: Une perle (dans un collier de perle) - glucose (dans l’amidon), - acide aminé (dans la protéine) Les polymères sont formés par une suite de monomères Exemples de polymères : Un collier de perle - amidon, protéine…

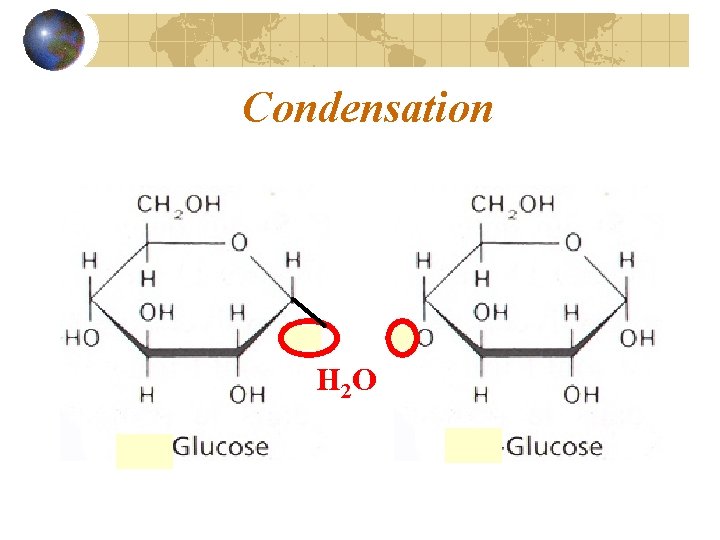
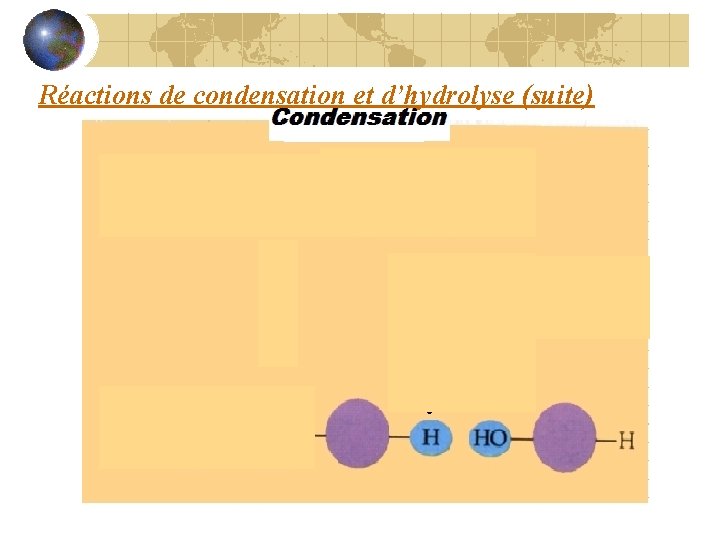
Réaction de condensation Les monomères se lient chimiquement par une réaction de condensation (production d’eau)

Condensation H 2 O

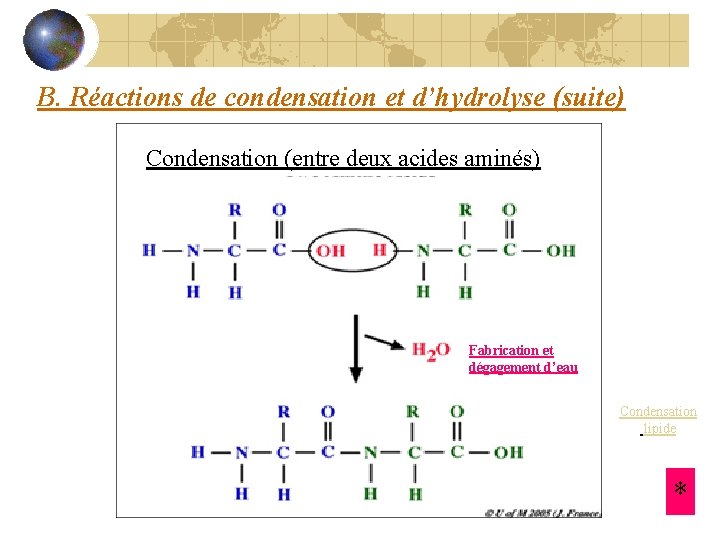
B. Réactions de condensation et d’hydrolyse (suite) Condensation (entre deux acides aminés) Fabrication et dégagement d’eau Condensation lipide *

Réactions de condensation et d’hydrolyse (suite)

Condensation lient Les monomères se _____ formée De l’eau est ____ Condensation =Diminution d’espace

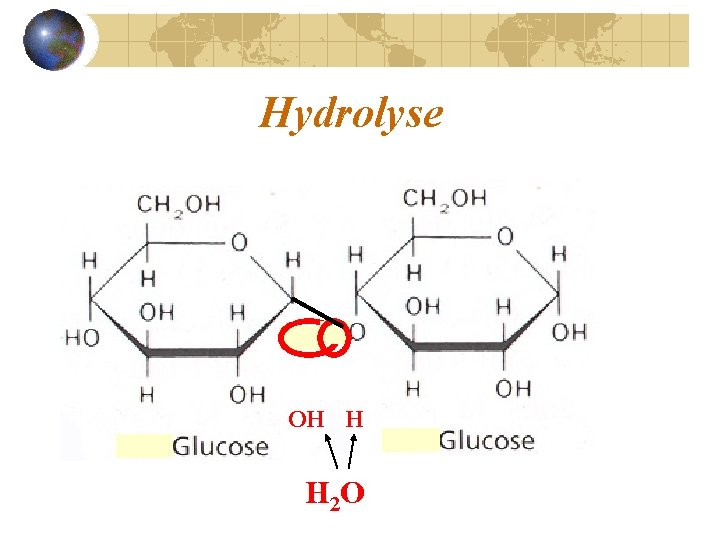
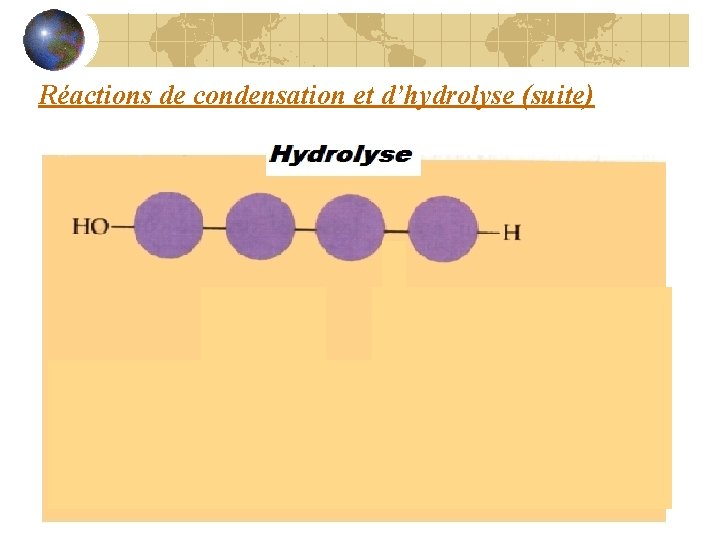
Réaction d’hydrolyse Les polymères se séparent en faisant l’hydrolyse. Le bris d’une molécule d’eau libère les ions H+ et OH-. Le point de séparation des monomères est comblé par ces ions.

Hydrolyse OH H H 2 O

Réactions de condensation et d’hydrolyse (suite)

Hydrolyse séparent Les monomères se _____ utilisée De l’eau est ____ eau Lyse = destruction Hydro = ___________ sont brisés… eau et polymère

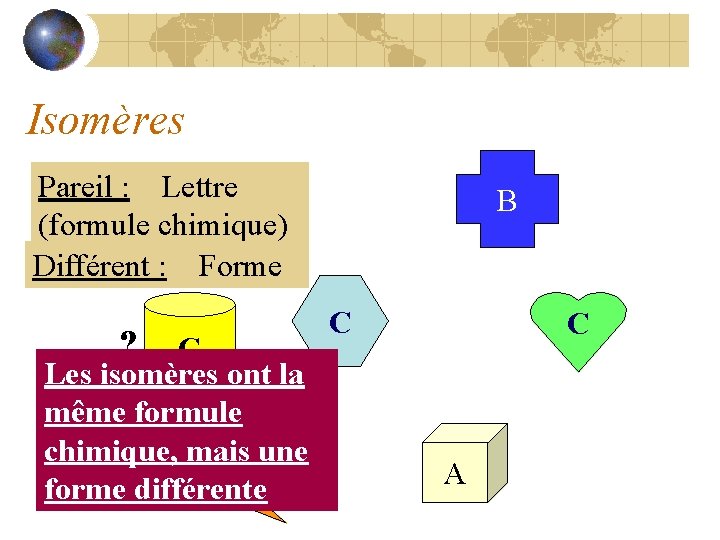
Isomères Pareil : Lettre (formule chimique) A Différent : Forme ? C Les isomères ont la même formule chimique, mais B une forme différente B C C A

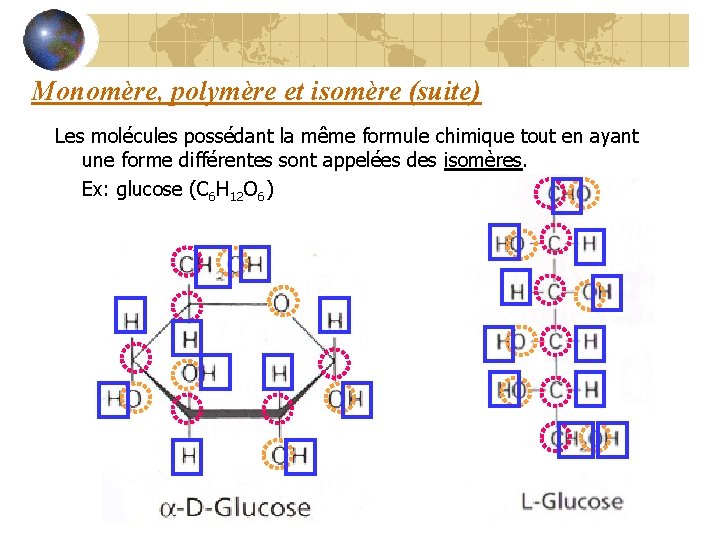
Monomère, polymère et isomère (suite) Les molécules possédant la même formule chimique tout en ayant une forme différentes sont appelées des isomères. Ex: glucose (C 6 H 12 O 6)
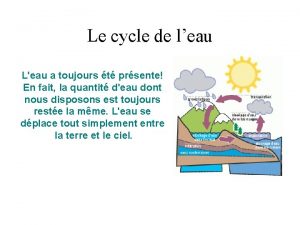
 Le cycle de la pluie
Le cycle de la pluie 5 regnes vivants
5 regnes vivants Haribo c'est beau la vie
Haribo c'est beau la vie Texte argumentatif et expressif
Texte argumentatif et expressif Coop mazout
Coop mazout Una dos y tres tres banderilleros en el redondel
Una dos y tres tres banderilleros en el redondel Uno dos y tres tres banderilleros en el redondel
Uno dos y tres tres banderilleros en el redondel Toutes les mamans du monde
Toutes les mamans du monde Pour les enfants du monde entier
Pour les enfants du monde entier Sdwan pour les nuls
Sdwan pour les nuls A toutes les mamans du monde
A toutes les mamans du monde Pour toutes les mamans du monde paroles
Pour toutes les mamans du monde paroles Je veux te chanter marie
Je veux te chanter marie Outil pour arracher les dents
Outil pour arracher les dents Les adjectifs démonstratifs s'utilisent pour
Les adjectifs démonstratifs s'utilisent pour Dmr pour les nuls
Dmr pour les nuls Construire les premiers outils pour structurer sa pensée
Construire les premiers outils pour structurer sa pensée Chiac pour les dummies
Chiac pour les dummies Ordre du jour pour les enseignants
Ordre du jour pour les enseignants