Gygyszerkutats Dr Zelk Romna Egyetemi Gygyszertr Gygyszergyi Szervezsi



































- Slides: 49

Gyógyszerkutatás Dr. Zelkó Romána Egyetemi Gyógyszertár Gyógyszerügyi Szervezési Intézet

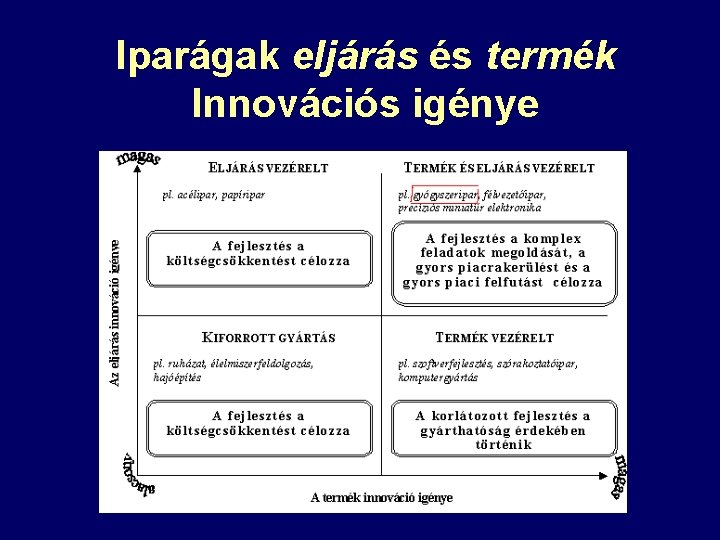
Iparágak eljárás és termék Innovációs igénye

Egy originális gyógyszer piacra viteléhez szükséges • 10 -14 év • 1 milliárd USD (sikertelen kutatások költsége) • Kb. 57 megkezdett project 1 forgalomba került vegyület • A gyógyszerkutatásban és -fejlesztésben alapvető: – alapkutatási eredmények gyors hasznosítása – résztvevők stratégiai szövetsége – hatóságokkal való együttműködés

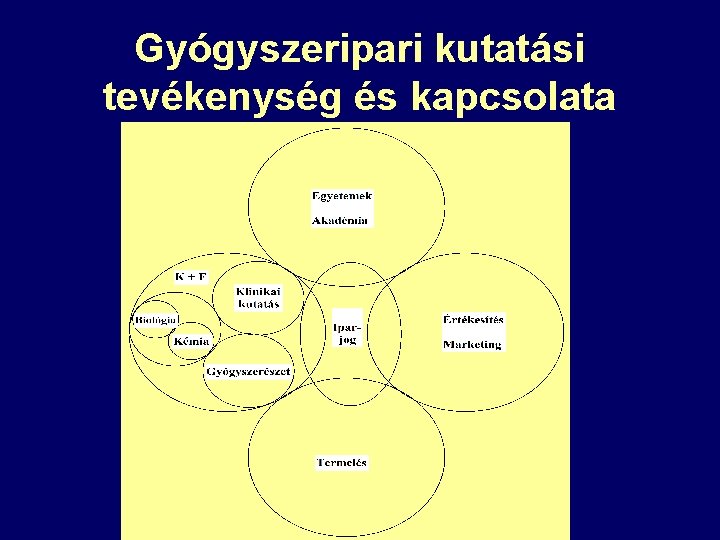
Gyógyszeripari kutatási tevékenység és kapcsolata

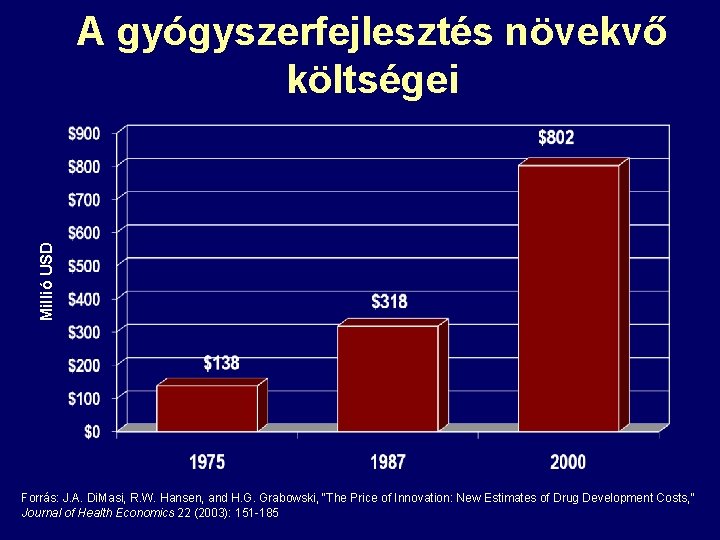
Millió USD A gyógyszerfejlesztés növekvő költségei Forrás: J. A. Di. Masi, R. W. Hansen, and H. G. Grabowski, “The Price of Innovation: New Estimates of Drug Development Costs, ” Journal of Health Economics 22 (2003): 151 -185

A laboratóriumtól a betegig 30, 000 Preklinikai vizsgálatok IND 5 év 1. 5 év FDA/EMA 10 vegyület 500 vegyület Vegyület Klinikai vizsgálatok NDA Felfedező kutatás 6 Years Átlagos időtartam IND = investigational new drug Forrás: Pharmaceutical Industry Profile, 2005, Ph. RMA Nagyüzemi gyártás/ Fázis IV Forgalomba hozatal 2 év

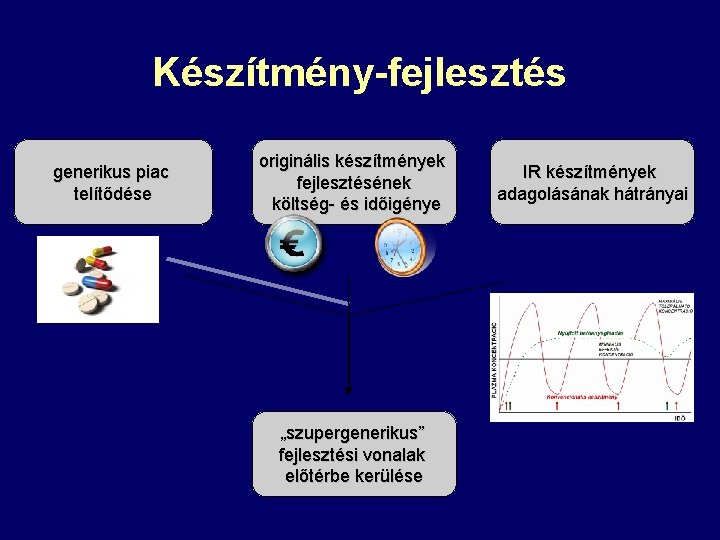
Készítmény-fejlesztés generikus piac telítődése originális készítmények fejlesztésének költség- és időigénye „szupergenerikus” fejlesztési vonalak előtérbe kerülése IR készítmények adagolásának hátrányai

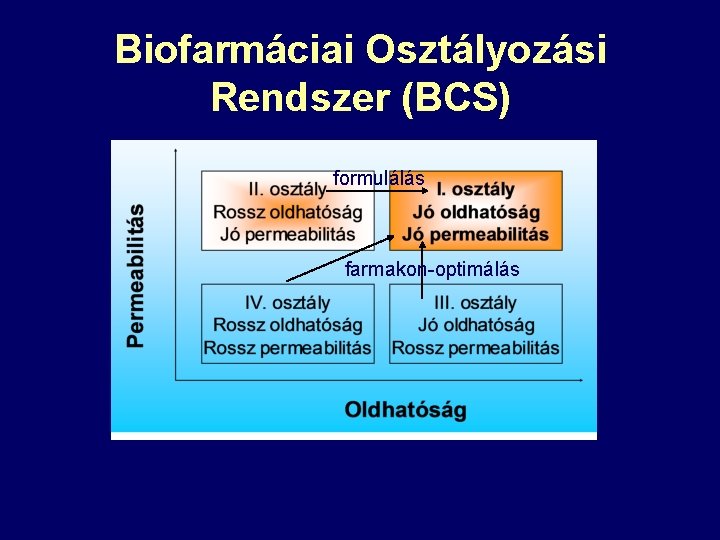
Mi jellemzi az új hatóanyagokat? • 40%-a a gyógyszerjelölt molekuláknak nem kerül piacra kedvezőtlen fizikai-kémiai tulajdonsága miatt – Rossz oldhatóság – Rossz permeabilitás – Alacsony lipofilitás – Gyenge metabolikus stabilitás

Biofarmáciai Osztályozási Rendszer (BCS) formulálás farmakon-optimálás

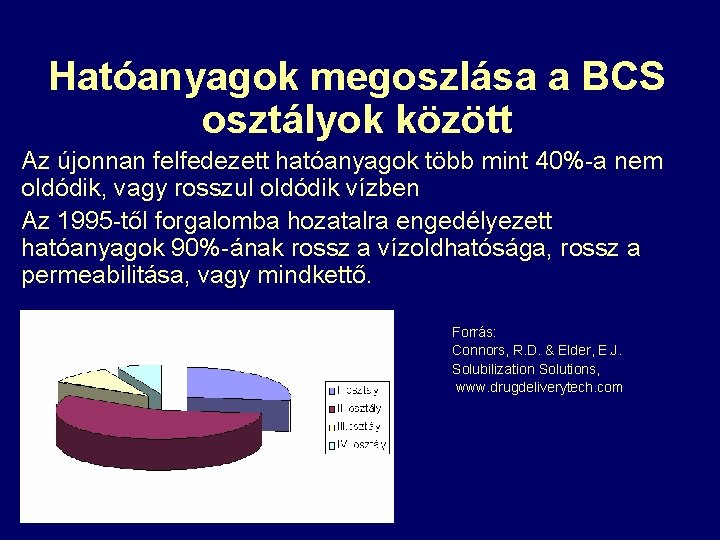
Hatóanyagok megoszlása a BCS osztályok között Az újonnan felfedezett hatóanyagok több mint 40%-a nem oldódik, vagy rosszul oldódik vízben Az 1995 -től forgalomba hozatalra engedélyezett hatóanyagok 90%-ának rossz a vízoldhatósága, rossz a permeabilitása, vagy mindkettő. Forrás: Connors, R. D. & Elder, E. J. Solubilization Solutions, www. drugdeliverytech. com

Az alaptulajdonságok együttváltozása Minél ionizáltabb a molekula, annál jobb a vízoldhatósága, de romlik a permeabilitása

Kihívások a formulálásban III. osztály problémás hatóanyagai: Egyre több biológiai hatóanyag (peptidek, proteinek, oligonukleotidok, DNS) II. osztály problémás hatóanyagai: Alacsony molekulatömegű hatóanyagok körében gyakori a kristályos polimorfizmus és a rossz vízoldhatóság.

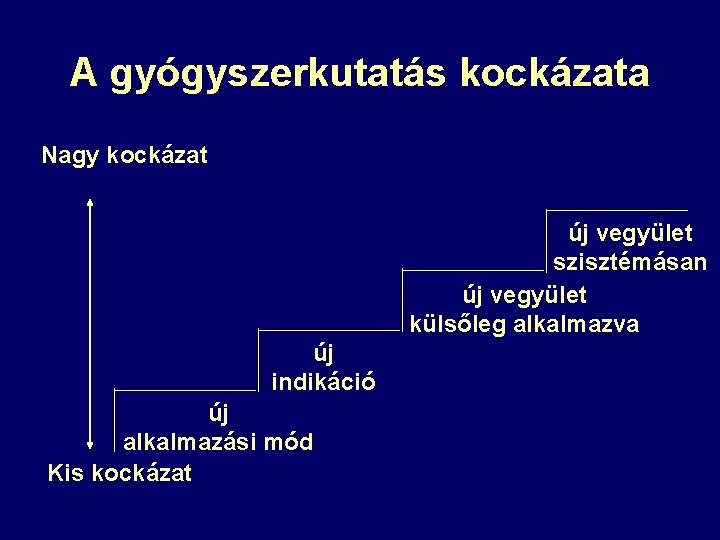
A gyógyszerkutatás kockázata Nagy kockázat új vegyület szisztémásan új vegyület külsőleg alkalmazva új indikáció új alkalmazási mód Kis kockázat

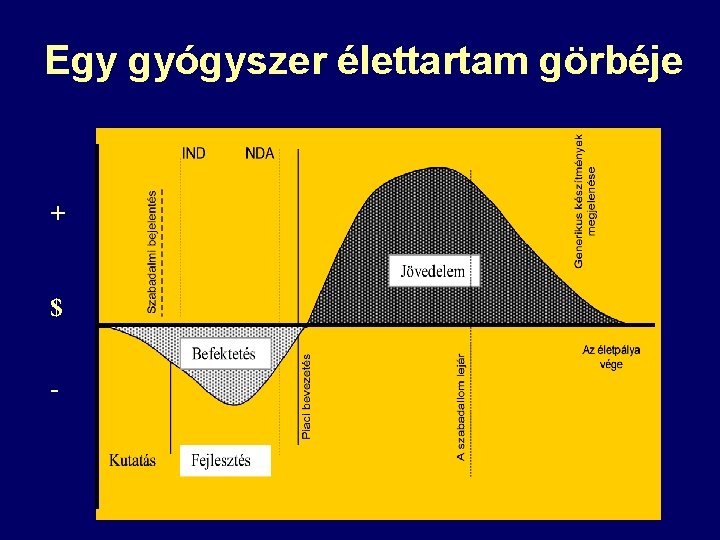
Egy gyógyszer élettartam görbéje + $ -

Gyógyszerkészítmények • Originális (innovatív) termékszabadalommal védett, a szabadalom lejártáig az originátor monopol jogokat élvez • Generikus - szabadalommal már nem védett, az originátor innovációjára építő saját fejlesztésű készítmény

Adat-kizárólagosság Az originátor törzskönyvi anyaga számára meghatározott ideig kizárólagosságot biztosít. Ez idő alatt az EU-ban bioekvivalencián alapuló gyorsított generikus törzskönyvezés nem végezhető el. (65/65, 87/21 sz. EEC rendelet és 2001/83/EC Direktíva)

A gyógyszerkutatás folyamata • Felfedező kutatási szakasz – a biológiai célpont (protein) és a vezérmolekula kiválasztása • Kutatás-fejlesztési szakasz

Új hatóanyag kutatás 1. Molekuláris célpont kiválasztása 2. Szűrővizsgálati módszer kidolgozása 3. Találatok 4. Vezérmolekulák szintézise

Fejleszthető vegyületek • Hatékony (nmol koncentrációban, reverzibilis kapcsolódás) • Szelektív • Kémiailag “jó” • Stabil • Jól felszívódó • Jó terápiás indexű • Relatív ártalmatlanságú

Új vezérmolekulák vagy eredeti munkahipotézis keresésének stratégiái • Meglévő hatóanyagok fejlesztése különböző kémiai átalakításokkal (“me too” terápiás másolatok) • Szisztematikus szűrés • Nagy áteresztőképességű szűrés (High Throughput Screening) • Biológiai információ kiaknázása • Tervezett kutatás és racionális megközelítés

Új vezérmolekulák vagy eredeti munkahipotézis keresésének stratégiái I. • Meglévő hatóanyagok fejlesztése különböző kémiai átalakításokkal (“me too” terápiás másolatok) – – nagyobb hatékonyság nagyobb specificitás kisebb toxicitás (nagyobb biztonság) könnyebb kezelhetőség/formulálás • Captopril (Enalapril - Merck, Ramipril - Hoechst, Perindopril Servier, Cilazapril - Hoffmann-La Roche, Delapril-Takeda, Lisinopril-Merck) • Pl. Penicillinek - Új antibiotikumok - szelektívebb • Új tulajdonság kerül előtérbe, új vezérmolekulát eredményezhet pl. Klórpromazin (antipszichotikus) Imipramin (antidepresszív)

Me-too készítmények követési ideje

Új vezérmolekulák vagy eredeti munkahipotézis keresésének stratégiái II. • Szisztematikus szűrés – Sok új természetes vagy szintetikus eredetű molekula szűrése a farmakológiai, terápiás potenciál meghatározására előzetes hipotézis nélkül • Tesztek: kötődési vizsgálatok, enzimgátlási mérések, izolált szerv vagy sejtkultúrán aktivitásmérés

Új vezérmolekulák vagy eredeti munkahipotézis keresésének stratégiái III. • Nagy áteresztőképességű szűrés (High Throughput Screening) – Robotok – In vitro tesztek miniatürizálása • HTS: 1. Radioligandumok elhelyezése 2. Enzimgátlás • Eredmény: sok ezer molekula 30 -50 teszten naponta • Vegyületforrások: – – – Gyárak vegyület könyvtárai Kereskedelmi forgalomban levő gyűjtemények Növényi kivonatok Fermentációs folyadékok Kombinatórikus kémia

Új vezérmolekulák vagy eredeti munkahipotézis keresésének stratégiái IV. • Biológiai információ kiaknázása • Megfigyelések emberen – Őshonos növények (népgyógyászat) • Az összes hatóanyag 30%-a (magisztrális receptekben 50%) Pl. kurare, szívglikozidok, opiátok, atropin, kokain, pilokarpin, efedrin, nikotin, teofillin – Mellékhatások klinikai megfigyelése • Mellékhatás fő hatássá válik pl. izoniazid (tuberkulosztatikum) antidepresszív • Nagy előnyük: megfigyelések közvetlenül emberen történtek – Ipari kémiai termékek szerencsés felfedezése • Pl. nitroglicerin, disulfiram • Megfigyelések állatokon • Pl. Vinca rosea - Patkányok akut szeptikémiája, leukocitopénia következtében • vinblasztin, vinkrisztin (tumorellenes hatás) • Megfigyelések növényeken és a mikrobiológiában • Növények: indolecetsav: növényi növekedési hormon klofibrát • Mikrobiológia: penicillin, kloramfenikol, tetraciklinek, rifampicin, cefalosporinok, streptomicin

Új vezérmolekulák vagy eredeti munkahipotézis keresésének stratégiái V. • Tervezett kutatás és racionális megközelítés – H 2 -receptor antagonisták (Black, 1960) – Ismert antihisztamin-vegyületek (H 1 -receptor antagonisták) nem antagonizálják a hisztamin által kiváltott gyomorsavszekréciót másik hisztamin receptor H 2 megalkotása, antagonista keresési program – Számítógépes molekulatervezés (Computer assisted Drug Design)

Emberi genom feltérképezése • Több gyógyszerkutatási célpont (akár 25 000 új célpont, elmúlt fél évszázadban az emberi szervezetben 500 támadáspont megcélzása) • Genome: egy faj teljes DNS szekvenciája – Proteome: a genome által kódolt teljes fehérjekészlet – Transcriptome: a genome-ból átírt teljes RNS készlet – Polimorfizmus: a populáció egyedeiben változó génszekvenciák

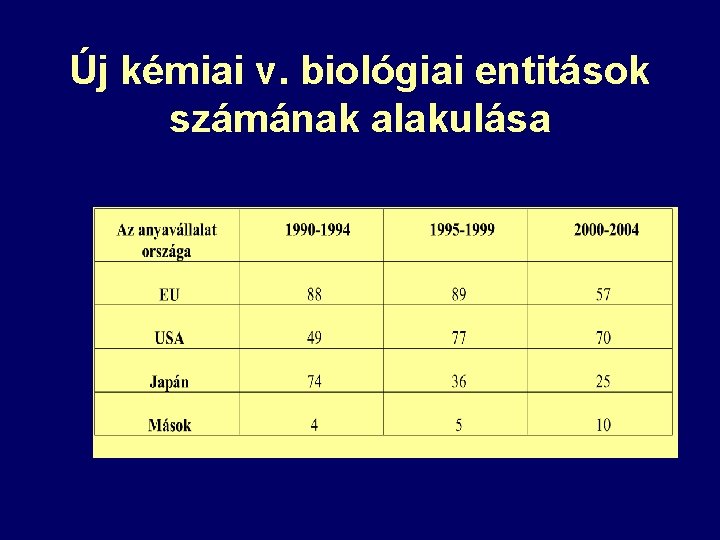
Új kémiai v. biológiai entitások számának alakulása

Készítményfejlesztés • Preklinikai gyógyszerfejlesztés – Toxikológiai értékelés • In vitro sejtkultúrákon értékelik a baktérium és emlős sejtosztódásra kifejtett hatást • Toxikológiai állatkísérletek, és metabolizmus vizsgálat – Farmakokinetika és farmakodinámia • ADME, BH • Klinikai értékelés

Preklinikai gyógyszerfejlesztés • Hatásosság és hatásmechanizmus (farmakodinámia) • Toxikológia (beleértve a teratogenitást és karcinogenitást) • Farmakokinetika/ADME • Gyógyszerészeti (beleértve a formuláció fejlesztését)

A gyógyszervizsgálatok szintjei IN VITRO TESZTEK ÁLLATKÍSÉRLETEK HUMÁN VIZSGÁLATOK - Hatékony-e és milyen dózisban emberben - Izolált sejteken, szöveteken van-e hatás -Ismert mellékhatások megerősítése - Veszélyt hordoz a sejtekre történő közvetlen hatás és azok elfogadhatóságának - A legígéretesebb vezérmolekula kiválasztása eldöntése -Korábbi vizsgálatokból nem ismert potenciális veszélyt hordozó hatás azonosítása - Megmutatja mi történik a vegyülettel egy teljes élő rendszerben - Mely vegyületek a legvalószínűbb, hogy hatékonyak az emberben -Segít meghatározni, hogy vajon a vegyület biztonságosan adható-e embernek, és milyen kezdő dózisban Korlátok - A várt hatás van-e a teljes élő rendszerben - Van-e veszélye a teljes élő rendszerre -Abszolút biztonsággal nem jelezhető előre, hogy mi történik emberben -Nem bizonyítható minden gyógyszert szedőn a hatás -Nem határozható meg minden lehetséges kockázat minden betegen -(genetikai különbségek, kórlefolyás változatossága) WHOLE ANIMAL EXPERIMENTS

Fázis 0 vizsgálat • Minél előbb információszerzés a molekula humán farmakokinetikájáról • Humán vizsgálatot előbbre hozzák, miközben még nem fejezték be a Fázis I-hez, a maximálisan tolerálható dózis meghatározásához az adatgyűjtést • Mikrodózis: terápiás dózis 1/100 -ad része, vagy kevesebb, nem lépheti túl a 100 µg-ot (fehérjéknél kb. 30 nanomol) • Farmakológiai hatás ritka • Általában egyszeri alkalmazásról van szó • Nem célja a maximálisan tolerálható dózis megállapítása

Klinikai értékelés Fázis Vizsgált Mintaszá személye m k Vizsgálat célja I 18 -50 év, egészséges férfi, önkéntes 20 -80 Feltáró: farmakológiai hatások, tolerancia (legnagyobb dózis), felszívódás, eloszlás, kiválasztás II Betegek 100 -300 Feltáró: hatásosság, optimális dózis, MH III Betegek 1000 -5000 Bizonyító: kedvező klinikai hatások, MH gyakoriság IV Betegek Változó Több információ (MH figyelés, mortalitás, morbiditás), alkalmazhatóság, promóció

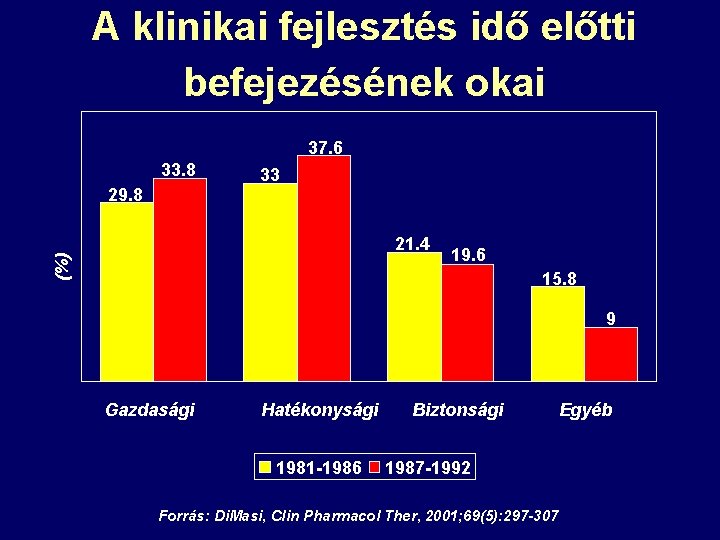
A klinikai fejlesztés idő előtti befejezésének okai 37. 6 33. 8 29. 8 33 (%) 21. 4 19. 6 15. 8 9 Gazdasági Hatékonysági 1981 -1986 Biztonsági 1987 -1992 Forrás: Di. Masi, Clin Pharmacol Ther, 2001; 69(5): 297 -307 Egyéb

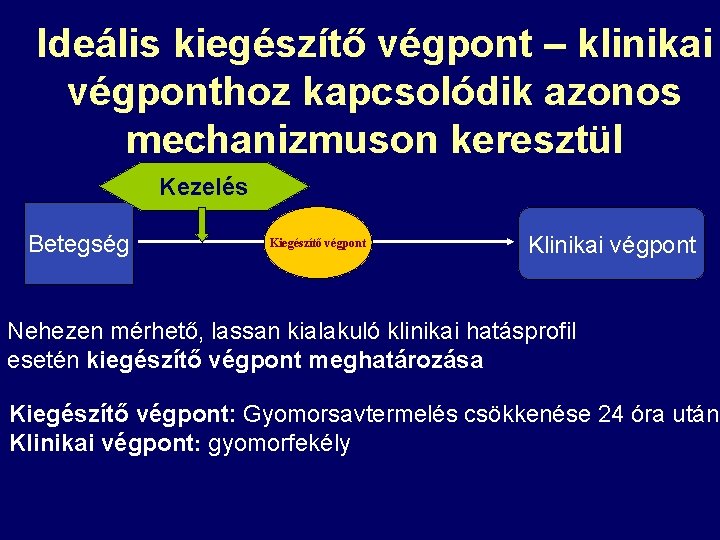
Ideális kiegészítő végpont – klinikai végponthoz kapcsolódik azonos mechanizmuson keresztül Kezelés Betegség Kiegészítő végpont Klinikai végpont Nehezen mérhető, lassan kialakuló klinikai hatásprofil esetén kiegészítő végpont meghatározása Kiegészítő végpont: Gyomorsavtermelés csökkenése 24 óra után Klinikai végpont: gyomorfekély

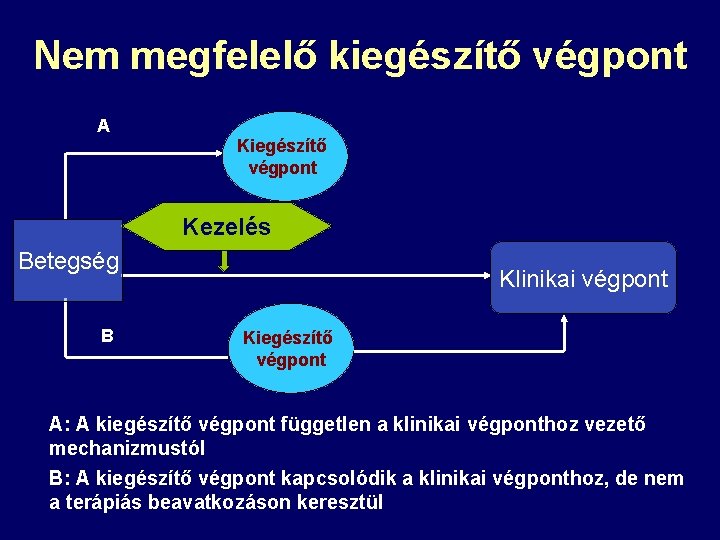
Nem megfelelő kiegészítő végpont A Kiegészítő végpont Kezelés Betegség B Klinikai végpont Kiegészítő végpont A: A kiegészítő végpont független a klinikai végponthoz vezető mechanizmustól B: A kiegészítő végpont kapcsolódik a klinikai végponthoz, de nem a terápiás beavatkozáson keresztül

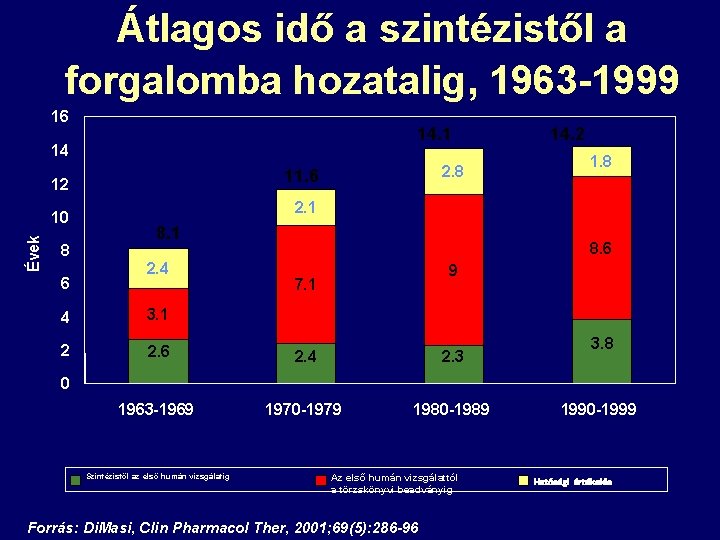
Átlagos idő a szintézistől a forgalomba hozatalig, 1963 -1999 16 14. 1 14 11. 6 12 Évek 10 8 6 2. 8 14. 2 1. 8 2. 1 8. 1 2. 4 8. 6 9 7. 1 4 3. 1 2 2. 6 2. 4 2. 3 1963 -1969 1970 -1979 1980 -1989 3. 8 0 Szintézistől az első humán vizsgálatig Az első humán vizsgálattól a törzskönyvi beadványig Forrás: Di. Masi, Clin Pharmacol Ther, 2001; 69(5): 286 -96 1990 -1999 Hatósági értékelés

Gyógyszerjelölt PREKLINIKAI FEJLESZTÉS GLP GMP Hatékonyság, szelektivitás, toxikológia KLINIKAI VIZSGÁLATOK FÁZIS II. GCP FÁZIS III. Forgalomba hozatali engedély FÁZIS IV.

A helyes laboratóriumi gyakorlat GLP • Olyan minőségügyi rendszer, amely a nemklinikai egészségügyi és környezetbiztonsági vizsgálatok szervezésével és lefolytatásával foglalkozik; magában foglalja azok tervezését, végrehajtását, ellenőrzését, dokumentálását, archiválását és zárójelentés kibocsátását.

GLP-szabályozás • Mire vonatkozik a GLP: új anyagok biztonsági vizsgálatai (egyes fizikai-kémiai és toxikológiai jellemzés) • A 90 -es évek közepéig: a laboratórium adott vizsgálatra alkalmazta, ezt bejelentve • 1997 -től: a laboratóriumnak jelentkeznie kell a Nemzeti Programba, ezt kihirdetik (nálunk: Eü. és FVM. Közlöny), felveszik a hatósági ellenőrzési tervbe

GLP hatásterületei • Toxikológia • Mutagenezis • Farmakokinetika (metabolizmus, toxikokinetika) • Biztonsági farmakológia • Fizikai-kémiai laboratórium • Klinikai kémia • Hematológia • Hisztológia • Patológia • Analitika

GLP alapelvek • A célja nem önmagában a vizsgálat tudományos értékének megállapítása • GLP alapelvek: szervezeti követelmények gyűjteménye

GLP célja Nyilvánvalóvá tegye a hibás negatív előfordulását (pl. Az eredmények nem-toxikusnak minősítik a toxikus anyagot)

GLP célja Nyilvánvalóvá tegye a hibás pozitív előfordulását (pl. Az eredmények toxikusnak minősítik a nem-toxikus anyagot)

GLP célja A vizsgálat kölcsönös elismerésének elősegítése nemzetközi határokon átívelően

GLP • Korlátozza a források pazarló felhasználását (állatok korlátozatt alkalmazása) • Biztosítja az eredmények megfelelő minőségét • Biztosítja az eredmények összehasonlíthatóságát • Elősegíti az eredmények kölcsönös elismerését (Preamble to Directive 87/18 EEC)

Eredeti magyar gyógyszerek Bevezetés éve 1963 1967 1969 1973 1974 1977 1980 1981 1982 1984 1986 1987 1989 1992 1996 Készítmény neve Kifejlesztő No-Spa Halidor Libexin Elobromol Probon Cavinton Sensit Jumex Tobanum Zyxoryn Grandaxin Tisacid Ebrimycin Loderix Arduan Hevizos Osteochin Enzaprost Curiosin Chinoin EGIS Chinoin Richter Chinoin Richter EGIS Alkaloida Chinoin EGIS Richter Biogal Chinoin Richter Hatásterület spazmolitikum köhögéscsillapító citosztatikum analgetikum memóriajavító koszorúértágító antiparkinson ágens antihipertenzív szer hepatoprotektív szer anxiolitikum antacid antibiotikum antiallergikum izomrelaxáns antivirális szer oszteoporózis ellen abortív szer sebkezelés

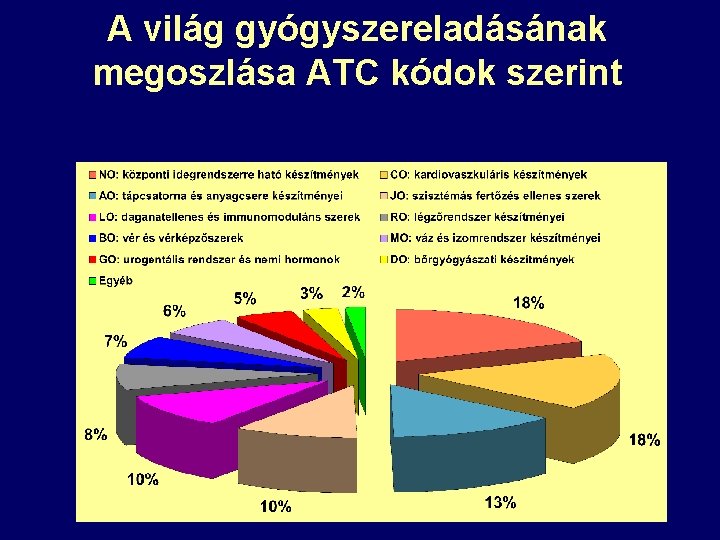
A világ gyógyszereladásának megoszlása ATC kódok szerint




























