EU penze stednm kolm Nzev vzdlvacho materilu Chemick










- Slides: 13

EU peníze středním školám Název vzdělávacího materiálu: Chemická vazba III. část – slabé vazebné interakce Číslo vzdělávacího materiálu: ICT 9/5 Šablona: III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Název sady vzdělávacích materiálů: Anorganická a obecná chemie Autor: Jakub Siegl Datum vytvoření: 18. 2. 2014 Garant (kontrola): Mgr. Šárka Kirchnerová Ročník: vyšší gymnázium Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Téma: Výukový materiál – chemická vazba Metodika/anotace: Prezentace slouží jako výukový materiál a jako opakování k maturitě z chemie. Jejím úkolem je názorně objasnit jednotlivé typy vazebných interakcí a zároveň vysvětlit jejich význam z pohledu chování chemických látek. Časový rozvrh: 25 min Gymnázium Františka Křižíka a základní škola, s. r. o.

Typy vazeb • Vazba je pojem zahrnující mnoho významů, proto je dobré si vazby rozdělit: 1. vazba chemická – z pohledu chemie nejvýznamnější – zahrnuje ty vazby, které jsou realizovány valenčními elektrony 2. vazba kovová – specifická vazba kovů 3. vazby fyzikální neboli slabé vazebné interakce – mezi ně řadíme zejména Van der Waalsovy síly a vodíkové můstky – tedy vazby realizované mezi opačně nabitými částmi dvou nebo více molekul

3. Slabé vazebné interakce • vazby, které nejsou realizovány valenčními elektrony, ale polarizovanými částmi molekul • v porovnání s chemickou vazbou jsou mnohem slabší • mají význam pro fyzikální vlastnosti látek – ovlivňují zejména teploty tání a varu • díky nim byla možná evoluce života na Zemi – bez těchto sil by byla voda za podmínek panujících na naší planetě v plynném stavu, stejně jako je na tom homologická molekula sulfanu • fungují jak mezi molekulami stejné látky, tak i mezi molekulami látek jiných

3. Slabé vazebné interakce • známe několik typů slabých vazebných interakcí, ale ty rozčleňujeme v zásadě do dvou velkých skupin: a. Van der Waalsovy síly – podstatou je vzájemné působení dipólů malých molekul – podle typu dipólu či síly a podstaty je dělíme ještě na: I. III. IV. V. disperzní síly interakce ion – dipól interakce dipól – dipól (coulombické síly) interakce dipól – indukovaný dipól hydrofobní interakce b. Vodíkové můstky (vazby) – vazba realizována u sloučenin s obsahem vodíku nesoucího parciální náboj

Van der Waalsovy síly disperzní síly: • představme si, že elektrony obíhají ve slupkách kolem jádra atomu popřípadě uvnitř malých nepolárních molekul – na krátký moment se zvýší koncentrace elektronů v určitém místě částice, což se projeví vznikem dipólu • pokud se k sobě přiblíží dvě částice s takovýmto dipólem, dojde k jejich synchronizaci a vzniku přitažlivých sil • umožňují zkapalnění látek – včetně vzácných plynů 1. 2. Obr. 1: http: //www. chem. purdue. edu/gchelp/liquids/disperse. html

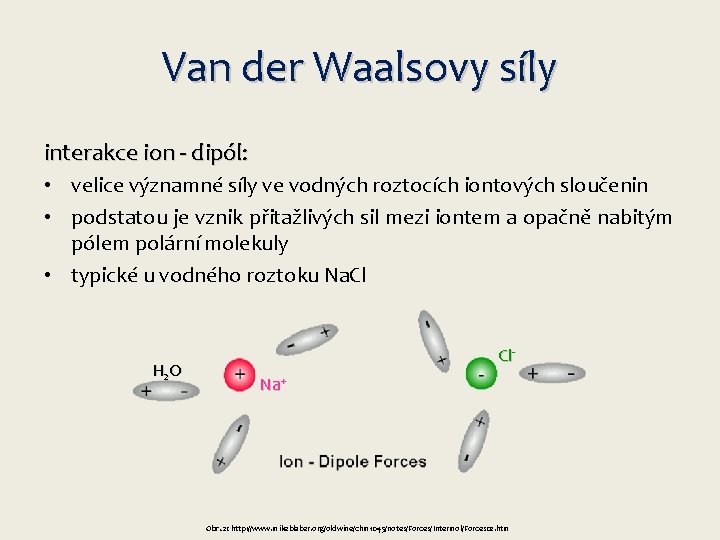
Van der Waalsovy síly interakce ion - dipól: • velice významné síly ve vodných roztocích iontových sloučenin • podstatou je vznik přitažlivých sil mezi iontem a opačně nabitým pólem polární molekuly • typické u vodného roztoku Na. Cl H 2 O Cl. Na+ Obr. 2: http: //www. mikeblaber. org/oldwine/chm 1045/notes/Forces/Intermol/Forces 02. htm

Van der Waalsovy síly interakce dipól - dipól: • velice významné síly ve vodných roztocích polárních sloučenin • podstatou je vznik přitažlivých sil mezi opačně nabitými póly polární molekuly • v rámci VDW sil nejsilnější typ • polární molekula je obklopena polárními molekulami rozpouštědla tzv. solvatovaným obalem Obr. 3: http: //2012 books. lardbucket. org/books/principles-ofgeneral-chemistry-v 1. 0 m/s 15 -02 -intermolecular-forces. html

Van der Waalsovy síly interakce dipól – indukovaný dipól: • velice podobný typ interakce předchozímu • dochází k ní při kontaktu polární a nepolární molekuly, která je působením polární molekuly dočasně polarizována (podobně jako u disperzních sil) • následuje vznik přitažlivých sil mezi opačně nabitými póly molekul • obdobně u interakce ion – indukovaný dipól Obr. 4: http: //chemwiki. ucdavis. edu/Physical_Chemistry/Quantum_Mechanics/Atomic_Theory/Intermolecular_Forces/Van_Der_Waals_Interactions

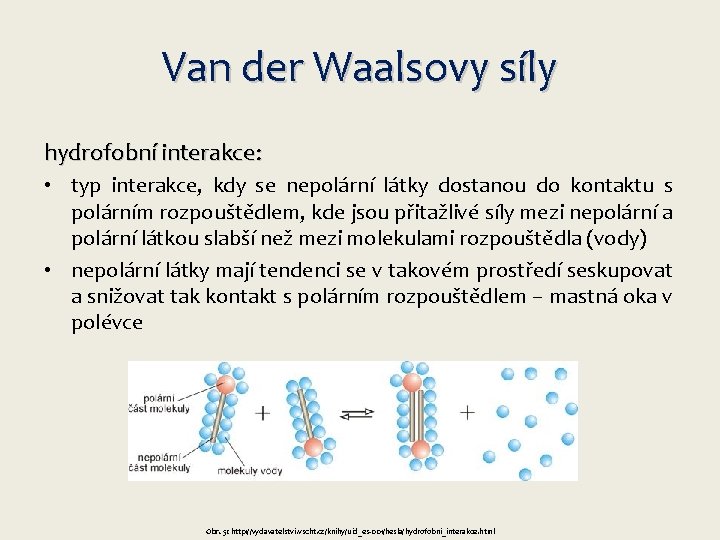
Van der Waalsovy síly hydrofobní interakce: • typ interakce, kdy se nepolární látky dostanou do kontaktu s polárním rozpouštědlem, kde jsou přitažlivé síly mezi nepolární a polární látkou slabší než mezi molekulami rozpouštědla (vody) • nepolární látky mají tendenci se v takovém prostředí seskupovat a snižovat tak kontakt s polárním rozpouštědlem – mastná oka v polévce Obr. 5: http: //vydavatelstvi. vscht. cz/knihy/uid_es-001/hesla/hydrofobni_interakce. html

Vodíkové můstky (vazby) • v porovnání s VDW silami je vodíkový můstek mnohem pevnější interakcí, přesto je ale asi tak desetkrát slabší než vazby chemické • význam není pouze chemický v úzkém slova smyslu, hraje vlastně tu nejvýznamnější roli z pohledu utváření života na Zemi – za normálních podmínek by byla voda totiž plynnou látkou, stejně jako sulfan či selan, tedy její homologové • ovlivňují zejména teploty tání a varu hlavně u látek s velmi nízkou molární hmotností – ty by měly mít logicky velmi nízké hodnoty, ale ve skutečnosti je opak pravdou • podmínky vzniku jsou tyto: a. přítomnost volných elektronových párů na některém z atomů vázaných v molekule b. vazba atomu vodíku na silně elektronegativní atom (F, O, N) Tabulka

Vodíkové můstky (vazby) • díky silné elektronegativitě vázaného atomu dochází k přesunutí sdíleného vazebného elektronového páru směrem k tomuto atomu → tím se zde zvýší výskyt záporných částic a naopak na druhém pólu reprezentovaném atomem vodíku dochází k odhalení kladného jádra – utváří se parciální náboje, které jsou základem pro tvorbu H můstků δ+ δ- Obr. 6: http: //chemvazba. moxo. cz/Lekce/lekce 9. html • další význam v přírodě – povrchové napětí → Obr. 7: http: //en. wikipedia. org/wiki/Surface_tension

Zdroje: (k 4. 2. 2014) Obr. 1: http: //www. chem. purdue. edu/gchelp/liquids/disperse. html Obr. 2: http: //www. mikeblaber. org/oldwine/chm 1045/notes/Forces/Intermol/Forces 02. htm Obr. 3: http: //2012 books. lardbucket. org/books/principles-of-general-chemistry-v 1. 0 m/s 15 -02 -intermolecularforces. html Obr. 4: http: //chemwiki. ucdavis. edu/Physical_Chemistry/Quantum_Mechanics/Atomic_Theory/Intermolecular_Forc es/Van_Der_Waals_Interactions Obr. 5: http: //vydavatelstvi. vscht. cz/knihy/uid_es-001/hesla/hydrofobni_interakce. html Obr. 6: http: //chemvazba. moxo. cz/Lekce/lekce 9. html Obr. 7: http: //en. wikipedia. org/wiki/Surface_tension Obr. 8: http: //www. e-chembook. eu/cz/doplnky/periodicke-tabulky

Zpět Obr. 8: http: //www. e-chembook. eu/cz/doplnky/periodicke-tabulky





















