ENLACE INICO Karla Goroztieta Rosales y Carlos Goroztieta





- Slides: 9

ENLACE IÓNICO Karla Goroztieta Rosales y Carlos Goroztieta Y Mora (2013)

ENLACE IÓNICO v. Se da entre metales y no-metales. v. Los metales tienen, en general, pocos electrones en su capa de valencia y tienden a perderlos para quedar con la capa anterior completa (estructura de gas noble) convirtiéndose en cationes. v. Los no-metales tienen casi completa su capa de valencia y tienden a capturar los electrones que les faltan convirtiéndose en aniones y conseguir asimismo la estructura de gas noble. 2

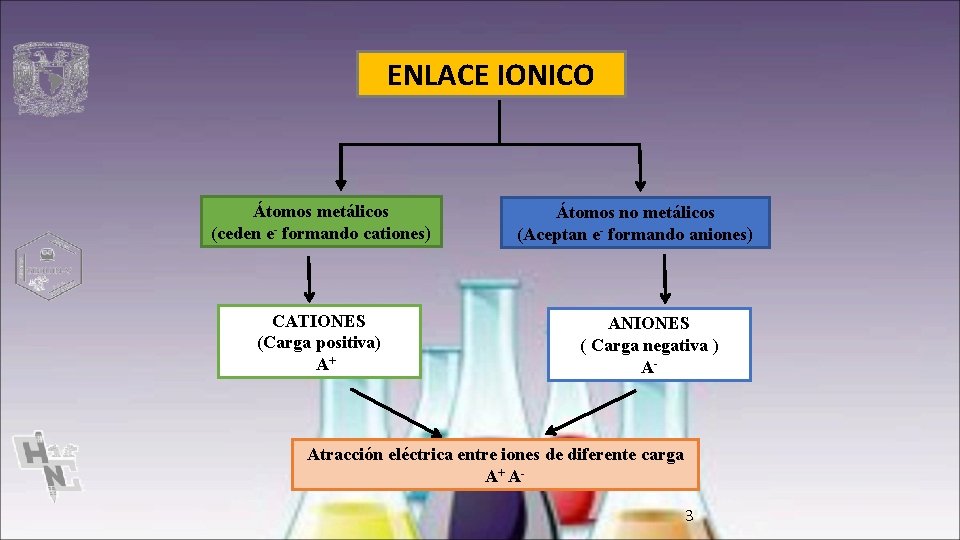
ENLACE IONICO Átomos metálicos (ceden e- formando cationes) CATIONES (Carga positiva) A+ Átomos no metálicos (Aceptan e- formando aniones) ANIONES ( Carga negativa ) A- Atracción eléctrica entre iones de diferente carga A+ A 3

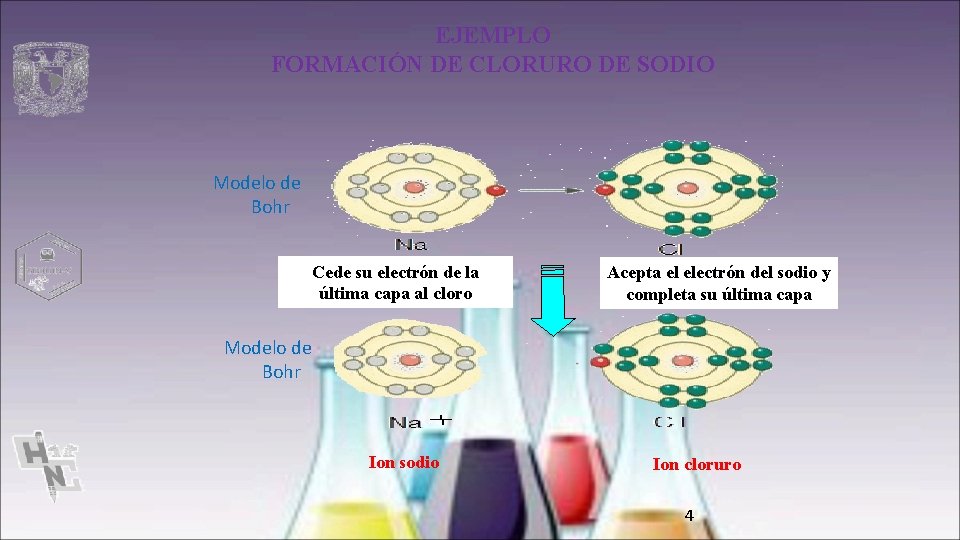
EJEMPLO FORMACIÓN DE CLORURO DE SODIO Modelo de Bohr Cede su electrón de la última capa al cloro Acepta el electrón del sodio y completa su última capa Modelo de Bohr Ion sodio Ion cloruro 4

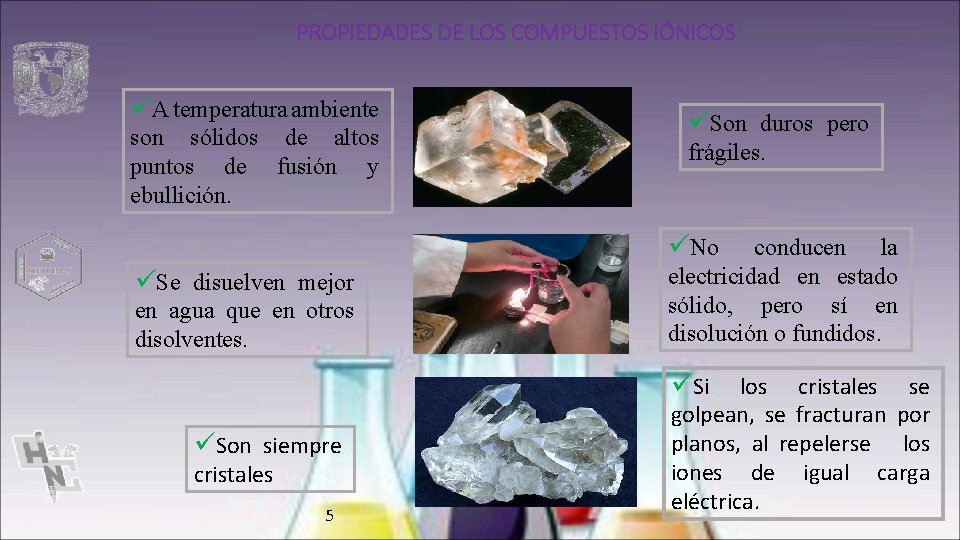
PROPIEDADES DE LOS COMPUESTOS IÓNICOS üA temperatura ambiente son sólidos de altos puntos de fusión y ebullición. üSon duros pero frágiles. üNo üSe disuelven mejor en agua que en otros disolventes. conducen la electricidad en estado sólido, pero sí en disolución o fundidos. üSi üSon siempre cristales 5 los cristales se golpean, se fracturan por planos, al repelerse los iones de igual carga eléctrica.

PROPIEDADES DE LOS COMPUESTOS IÓNICOS 1. Son sólidos con punto de fusión altos (por lo general, > 400ºC) 2. Muchos son solubles en disolventes polares, como el agua. . 3. La mayoría es insoluble en disolventes no polares, como el hexano C 6 H 14. 4. Los compuestos fundidos conducen bien la electricidad porque contienen partículas móviles con carga (iones) 5. Las soluciones acuosas conducen bien la electricidad porque contienen partículas móviles con carga (iones). 6

VALORES DE ELECTRONEGATIVIDAD DE PAULING Linus Pauling definió la electronegatividad como La capacidad que tienen los átomos de atraer y retener los electrones que participan en un enlace químico. 7

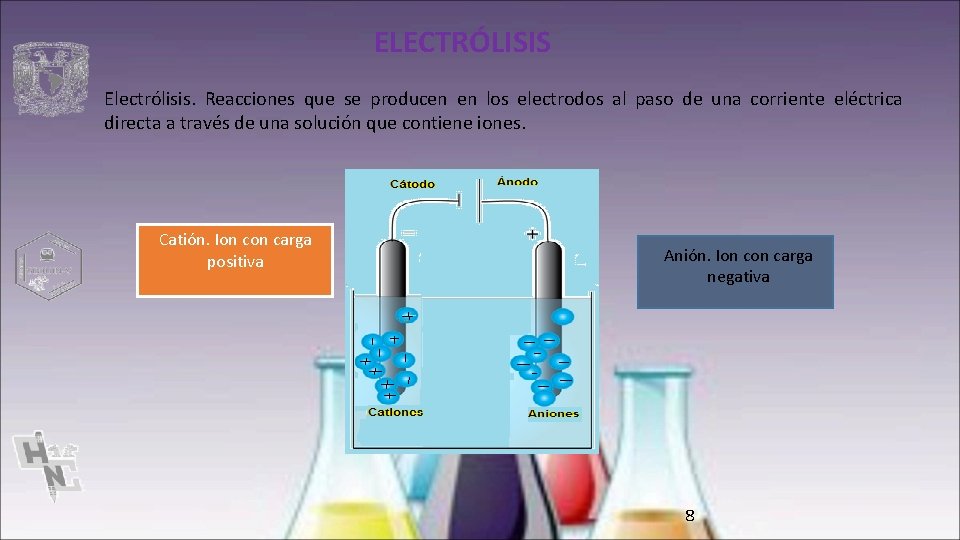
ELECTRÓLISIS Electrólisis. Reacciones que se producen en los electrodos al paso de una corriente eléctrica directa a través de una solución que contiene iones. Catión. Ion carga positiva Anión. Ion carga negativa 8

Conceptos de oxidación y reducción Oxidación. Pérdida de electrones La oxidación se lleva a cabo en el ánodo Reducción. Ganancia de electrones La reducción se lleva a cabo en el cátodo 9

















