ELEMENTLER ARASINDAK PERYODK LKLER Kaynak Fen ve Mhendislik


![Temsilci (Baş grup) Elementlerinin Anyon ve Katyonlarının Elektronik Konfigurasyonları Na [Ne]3 s 1 Na+ Temsilci (Baş grup) Elementlerinin Anyon ve Katyonlarının Elektronik Konfigurasyonları Na [Ne]3 s 1 Na+](https://slidetodoc.com/presentation_image_h2/65410b56086232795c701ce2f997f6ef/image-5.jpg)




- Slides: 21

ELEMENTLER ARASINDAKİ PERİYODİK İLİŞKİLER Kaynak: Fen ve Mühendislik Bilimleri için KİMYA Raymond Chang

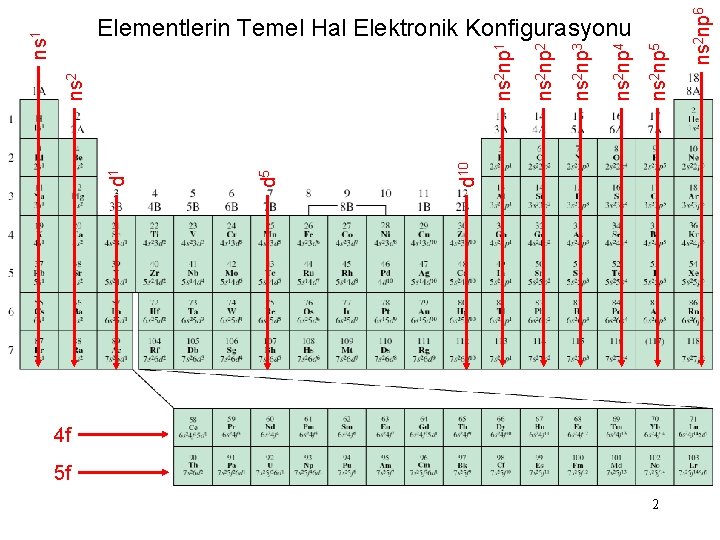
4 f 5 f 2 ns 2 np 6 ns 2 np 5 ns 2 np 4 ns 2 np 3 ns 2 np 2 ns 2 np 1 d 10 d 5 d 1 ns 2 ns 1 Elementlerin Temel Hal Elektronik Konfigurasyonu

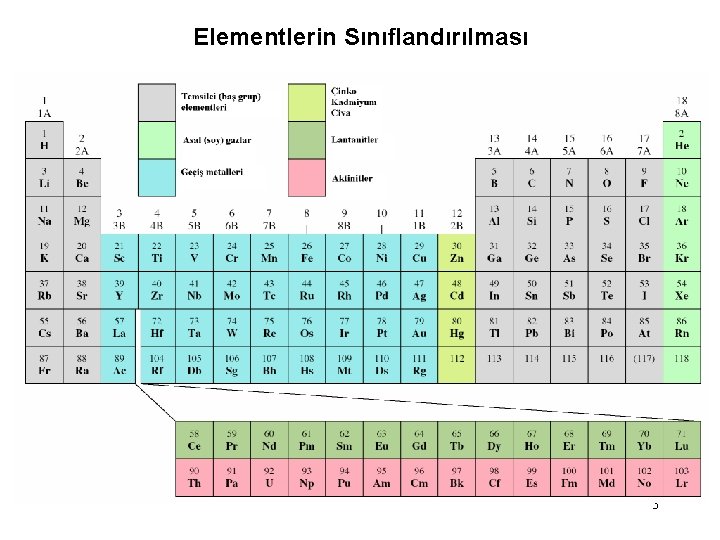
Elementlerin Sınıflandırılması 3

Baş grup elementleri: 1 A dan 7 A ya kadar olan tüm gruplardaki elementlerdir. En yüksek ana grup kuantum sayısının s ve p orbitalleri tam dolu değildir. Soy gazlar (Asal gazlar): He (1 s 2) dışında ns 2 np 6 elektronik konfigurasyonunda olan asal gazların p alt kabukları tamamen doludur. Geçiş metalleri: 3 B – 8 B, 1 B – 2 B grup elementleri olup, tam dolu olmayan d alt kabukları ile karakterize edilirler, kolayca katyon olştururlar. Zn, Cd ve Hg ne temsilci ne de geçiş elementidir. . Lantanitler ve Aktinitler: f alt kabukları tam dolu olmayan elementlerdir.
![Temsilci Baş grup Elementlerinin Anyon ve Katyonlarının Elektronik Konfigurasyonları Na Ne3 s 1 Na Temsilci (Baş grup) Elementlerinin Anyon ve Katyonlarının Elektronik Konfigurasyonları Na [Ne]3 s 1 Na+](https://slidetodoc.com/presentation_image_h2/65410b56086232795c701ce2f997f6ef/image-5.jpg)
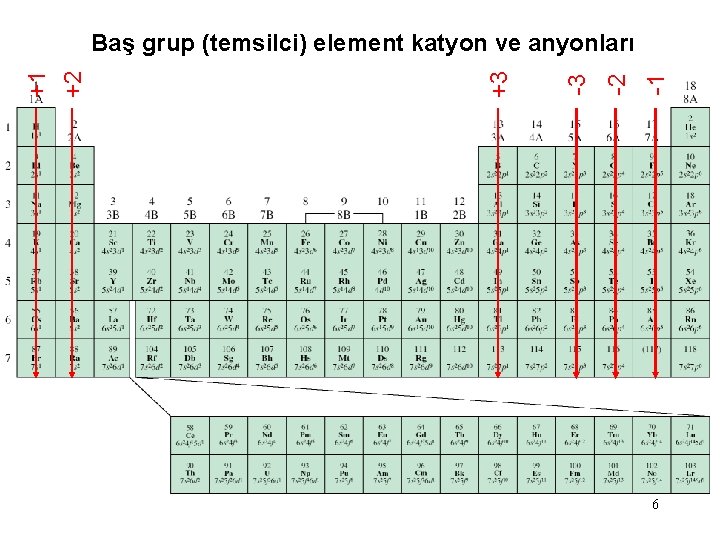
Temsilci (Baş grup) Elementlerinin Anyon ve Katyonlarının Elektronik Konfigurasyonları Na [Ne]3 s 1 Na+ [Ne] Ca [Ar]4 s 2 Ca 2+ [Ar] Al [Ne]3 s 23 p 1 Al 3+ [Ne] Atomlar elektron alarak “anyon” olarak adlandırılırlar e kazandıklarında elektronik konfigurasyonları soy gazların elektronik konfigurasyonuna benzer Atomlar elektron kayberek “katyon” olarak adlandırılırlar e kaybettiklerinde elektronik konfigurasyonları soy gazların elektronik konfigurasyonuna benzer H 1 s 1 H- 1 s 2 veya [He] F 1 s 22 p 5 F- 1 s 22 p 6 veya [Ne] O 1 s 22 p 4 O 2 - 1 s 22 p 6 veya [Ne] N 1 s 22 p 3 N 3 - 1 s 22 p 6 veya [Ne] 5

-1 -2 -3 +3 +1 +2 Baş grup (temsilci) element katyon ve anyonları 6

Izoelektronik: aynı sayıda elektrona sahip olan ve böylece aynı temel hal elektronik konfigurasyonuna sahip olan atomlardır. Na+: [Ne] Al 3+: [Ne] O 2 -: 1 s 22 p 6 or [Ne] F-: 1 s 22 p 6 yada [Ne] N 3 -: 1 s 22 p 6 yada [Ne] Na+, Al 3+, F-, O 2 -, and N 3 - Ne ile izoelektronik tir. H- ile izoelektronik olan nötral atom hangisidir ? H-: 1 s 2 He ile aynı elektronik konfigurasyondadır. 7

Geçiş elementlerine ait katyonların elektronik konfigurasyonları Bir geçiş metalinin katyonu oluşurken elektron önce ns daha sonra (n-1) d orbitalinden verilir. Fe: [Ar]4 s 23 d 6 Fe 2+: [Ar]4 s 03 d 6 or [Ar]3 d 6 Mn: [Ar]4 s 23 d 5 Mn 2+: [Ar]4 s 03 d 5 or [Ar]3 d 5 Fe 3+: [Ar]4 s 03 d 5 or [Ar]3 d 5 8

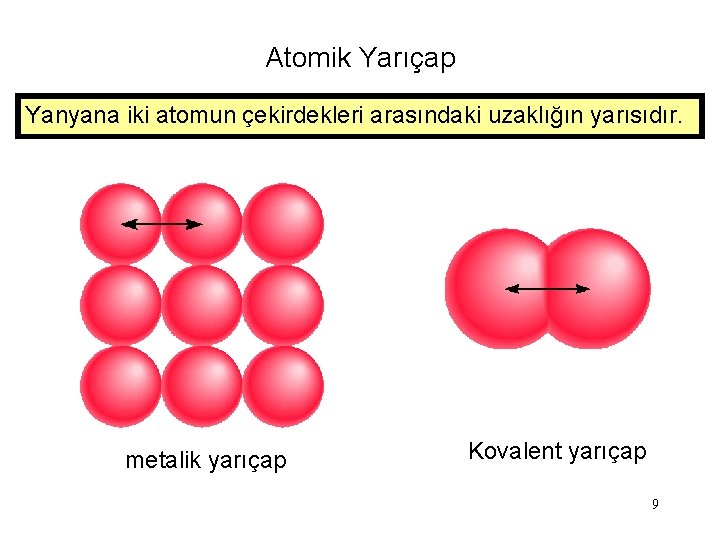
Atomik Yarıçap Yanyana iki atomun çekirdekleri arasındaki uzaklığın yarısıdır. metalik yarıçap Kovalent yarıçap 9

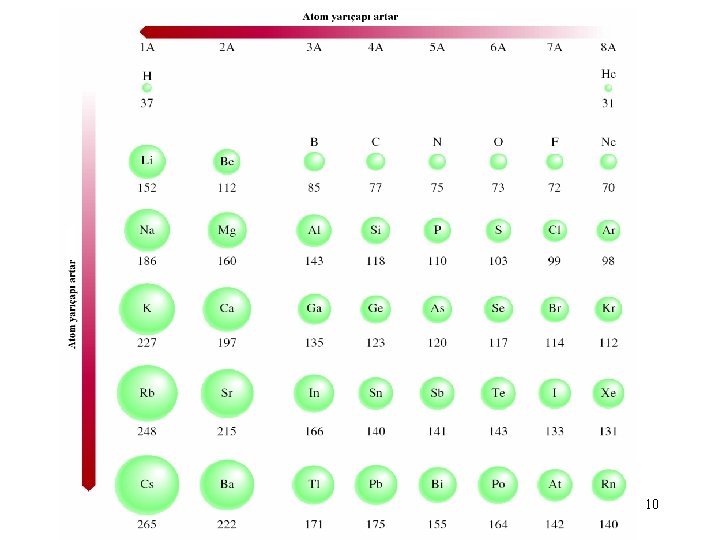
10

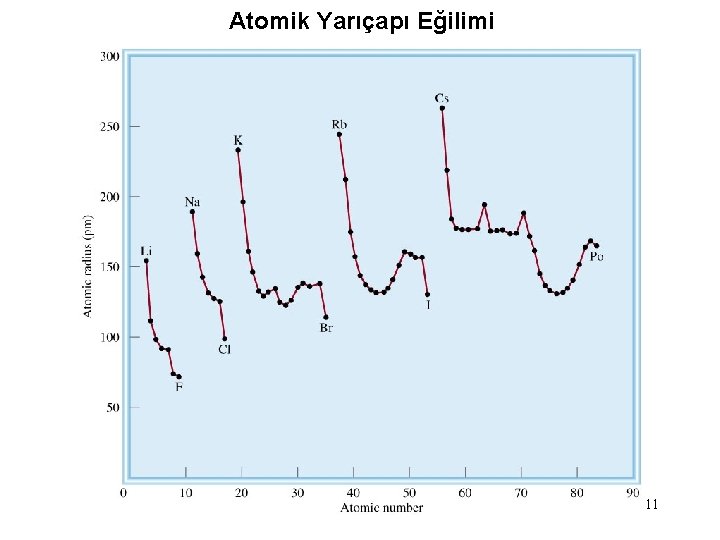
Atomik Yarıçapı Eğilimi 11

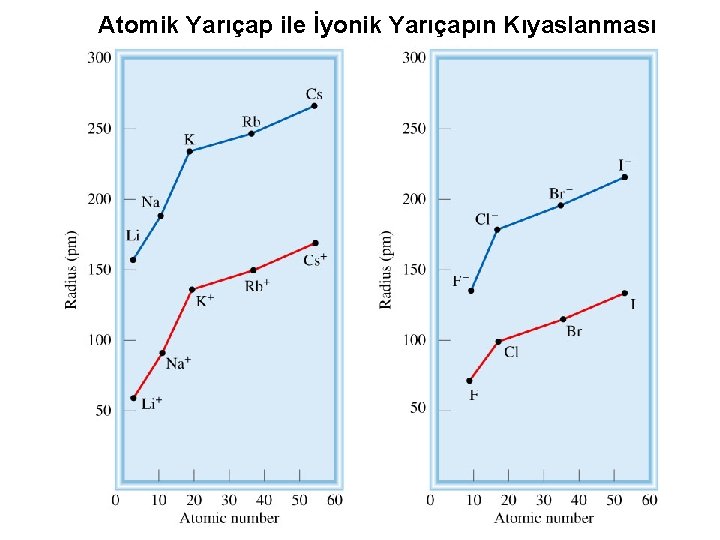
Atomik Yarıçap ile İyonik Yarıçapın Kıyaslanması 12

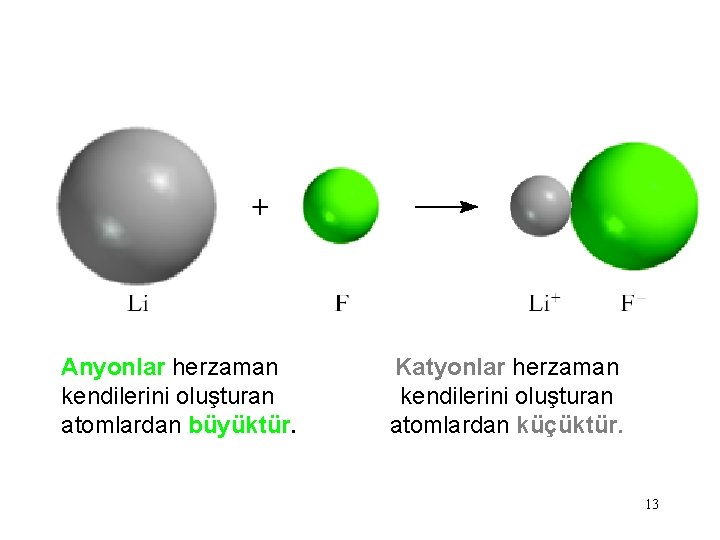
Anyonlar herzaman kendilerini oluşturan atomlardan büyüktür. Katyonlar herzaman kendilerini oluşturan atomlardan küçüktür. 13

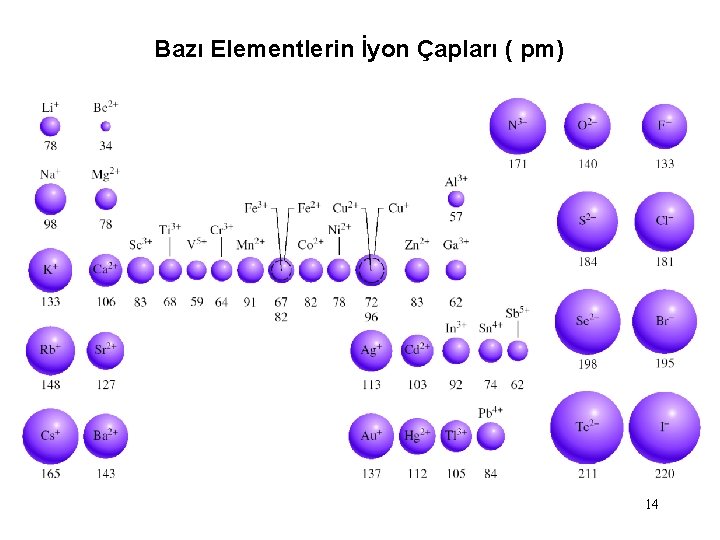
Bazı Elementlerin İyon Çapları ( pm) 14

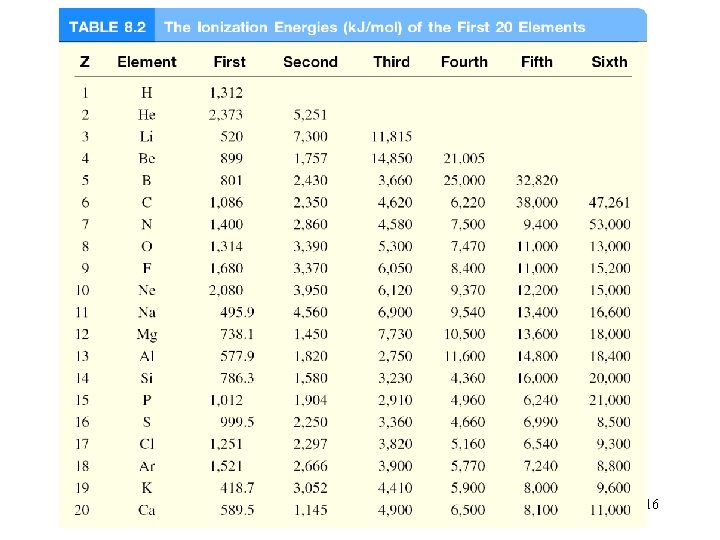
İyonizasyon Enerjisi temel halde bulunan gaz fazındaki bir atomdan bir elektron kopartılması için gereken (kj/mol) cinsinden minimum enerjidir. I 1 + X (g) X+(g) + e- I 1 birinci iyonizasyon enerjisi I 2 + X+(g) X 2+(g) + e- I 2 ikinci iyonizasyon enerjisi I 3 + X 2+(g) X 3+(g) + e- I 3 üçüncü iyonizasyon enerjisi I 1 < I 2 < I 3 15

16

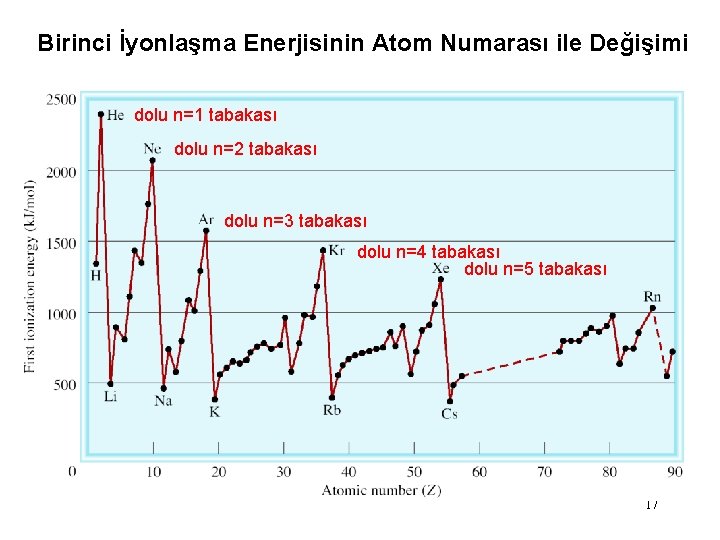
Birinci İyonlaşma Enerjisinin Atom Numarası ile Değişimi dolu n=1 tabakası dolu n=2 tabakası dolu n=3 tabakası dolu n=4 tabakası dolu n=5 tabakası 17

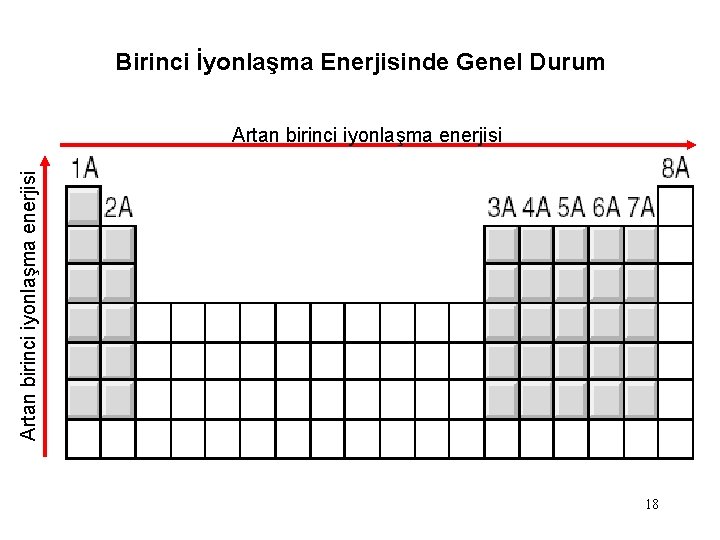
Birinci İyonlaşma Enerjisinde Genel Durum Artan birinci iyonlaşma enerjisi 18

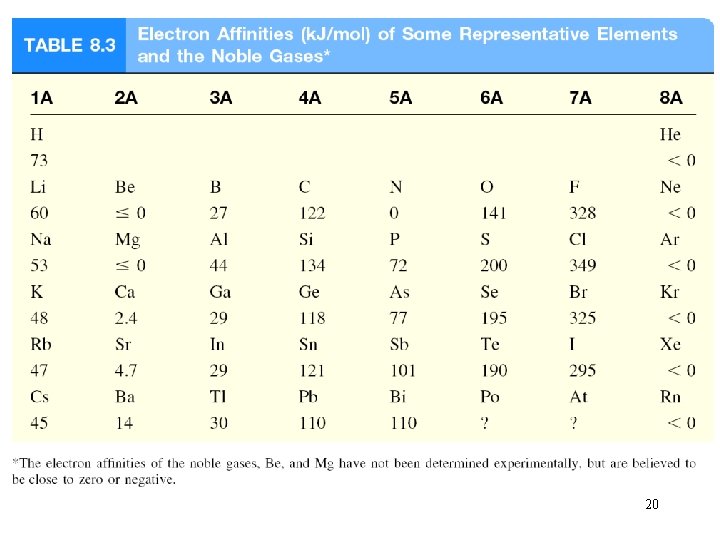
Elektron ilgisi gaz fazındaki bir atomun bir elektron alarak anyona dönüşmesi sırasında açığa çıkan enerjidir. X (g) + e- X-(g) F (g) + e- X-(g) DH = -328 k. J/mol EA = +328 k. J/mol O (g) + e- O-(g) DH = -141 k. J/mol EA = +141 k. J/mol 19

20

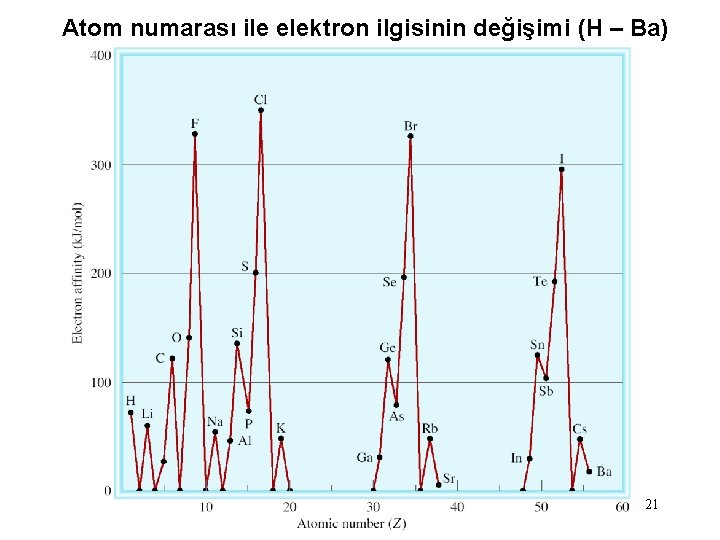
Atom numarası ile elektron ilgisinin değişimi (H – Ba) 21
 Lkler
Lkler Lkler
Lkler Ultra eser elementler
Ultra eser elementler Sembolü tek harfli olan elementler
Sembolü tek harfli olan elementler Ekstrakromozomal genetik elementler
Ekstrakromozomal genetik elementler Kaç çeşit element vardır
Kaç çeşit element vardır Dalton'un karbon elementi için kullandığı sembol nedir
Dalton'un karbon elementi için kullandığı sembol nedir Proteinlerin yapısında bulunan elementler
Proteinlerin yapısında bulunan elementler Kalay sodyum fosfor element sembolleri
Kalay sodyum fosfor element sembolleri Eser elementler
Eser elementler Rutherfort
Rutherfort Tel ve levha haline getirilebilen elementler
Tel ve levha haline getirilebilen elementler 7. element nedir
7. element nedir Elementler ve sembolleri
Elementler ve sembolleri Metaller ve sembolleri
Metaller ve sembolleri Diyamanyetik elementler
Diyamanyetik elementler Saf maddeler nelerdir
Saf maddeler nelerdir Kaynak gösterimi
Kaynak gösterimi Fon akım tablosunda fon kullanımı
Fon akım tablosunda fon kullanımı Emel kaynak
Emel kaynak Kaynak hatalari
Kaynak hatalari Varlık ve kaynak hesapları
Varlık ve kaynak hesapları