Elektroanalitik Yntemlerin snflandrlmas Elektroanalitik yntemler 1 yzey yntemleri


























- Slides: 26


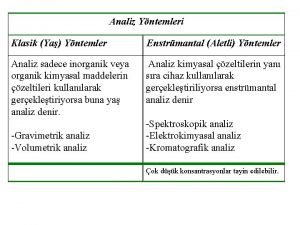
Elektroanalitik Yöntemlerin sınıflandırılması Elektroanalitik yöntemler : 1) yüzey yöntemleri 2) Çözelti yöntemleri olmak üzere ikiye ayrılır. Yüzey yöntemleri: a)Statik yöntemler : Potansiyometri ve potansiyometrik titrasyonlar b)Dinamik yöntemler: Kontrollü potansiyel ve sabit akım olmak üzere kendi arasında ikiye ayrılır.

• Kontrollü potansiyel: Sabit elektrot potansiyeli, voltametri, amperometrik titrasyon ve elektrogravimetri • Sabit akım yöntemleri: Kulometrik titrasyon ve elektrogravimetri • Çözelti yöntemleri: Kondüktometri ve kondüktometrik titrasyon

Potansiyometrik yöntemler • elektrokimyasal hücrelerin potansiyellerini, net akımın sıfıra yakınken ölçme esasına dayanır.

Potansiyometrik yöntemler v. Titrasyonların dönüm noktalarını belirlemede kullanılmıştır. vİyon-seçici membran elektrotların potansiyellerinden iyon derişimleri doğrudan ölçülür.

• İyon-seçici membran elektrotlar, Ø yabancı türlerden fazla etkilenmez Ø pek çok önemli anyon ve katyonların tayini için hızlı, kolay ve tahribatsız bir yöntemdir.

Potansiyometrik yöntemler • İmalatçılar, bir çok tüketim maddesinin p. H’sını ölçer • Klinik laboratuvarlarda hastalıkların seyrini takip için önemli bir gösterge olan kan gazları derişimleri ölçülür • Sanayi ve şehir atık sularında, sürekli olarak, p. H ve kirletici derişimleri tayin edilir

• Temel araştırmalarda, Kb ve Kçç gibi termodinamik denge sabitleri tayin edilir

Referans elektrot • analit çözeltisinin bileşiminden bağımsız, belli bir sıcaklıkta sabit elektrot potansiyeline sahip bir yarı-hücredir

• İdeal bir referans elektrot, • tam olarak bilinen, sabit ve analit çözeltisinin bileşiminden hiç etkilenmeyen bir potansiyele sahiptir. • hazırlanması kolay olmalıdır ve küçük akımlar geçerken sabit bir potansiyel oluşmalıdır.

İndikatör elektrot • analit derişimi ile bilinen bir bağıntıya göre potansiyeli değişen elektrot sistemidir. • İdeal bir indikatör elektrot, deney çözeltisindeki bir tek iyonun (veya iyon grubunun) derişimindeki değişmelere hızlı ve tekrarlanabilir bir şekilde cevap verir.

1. Metalik ( birinci sınıftan elektrotlar) 2. İkinci ve üçüncü sınıftan elektrotlar 3. İnert elektrotlar 4. İyon seçici alan etkili transistörler Potansiyometrik analizlerle, analitin aktiviteleri cinsinden veriler elde edilir

1. Birinci sınıftan elektrotlar 2. Gümüş, kurşun, civa, bakır , çinko, kadmiyum gibi metaller indikatör elektrot olarak kullanılır. 3. bu elektrotların reaksiyonları tersinir ve tekrarlanabilir.

• Birinci sınıftan Elektrotlar 1. Nötral çözeltilerde Ag/Ag+ ve Hg/Hg 2+ 2. Havası uzaklaştırılmış çözeltilerde Cu/Cu 2+, Zn/Zn 2+, Cd/Cd 2+, Bi/Bi 3+, Tl/Tl+ ve Pb/Pb 2

• İkinci ve üçüncü sınıftan Elektrotlar: Metalik elektrotlar sadece kendi iyonlarına değil iyonlarıyla suda az çözünen bileşikler veren anyonların aktivitelerine de duyarlıdır.

• İkinci ve üçüncü sınıftan Elektrotlar

• Redoks Sistemleri için İnert Metalik Elektrotlar • Platin-altın-palladyum-karbon • temasta oldukları redoks sistemlerinin potansiyellerine cevap verir.

Potansiyometrik tayinler için bir hücre Potansiyometrik ölçümlerde referans elektrot sol elektrot olarak işlem görür

Potansiyometrik yöntemler • Potansiyometrik yöntemler için gerekli araç-gereçler, basit ve ucuz • Referans elektrot • İndikatör elektrot • Potansiyel ölçme sistemi

Potansiyometrik yöntemler

• Derişimleri farklı iki asit çözeltisi özel olarak yapılmış ince bir cam yüzey ile ayrılırsa cam yüzeyin iki tarafı arasında bir potansiyel farkı meydana gelir. Bu potansiyel farkı: • E= K+ 0, 059 log a 1/a 2 • a 1 ve a 2 çözeltilerin hidrojen aktivitelerini gösterir.

Cam elektrotlarda görülen hatalar • • • Asit hatası Asimetri hatası Alkali hatası Elektrodun kuruması Düşük iyonik şiddet hatası Temas potansiyelinin değişmesi

• Asit hatası: Düşük p. H larda görülen hatadır. • Asimetri hatası: Camın her iki yüzeyinin farklı olmasından kaynaklanan hatadır. • Alkali hatası: Düşük hidrojen iyonu derişimlerinde görülen hatadır. • Elektrodun kuruması: Elektrodun iç çözeltisi ve bekletilme süresince kurutulmamalıdır. Sık sık kontrol edilmelidir. • Temas potansiyelindeki değişme: Kullanılan

• Standart ve numune çözeltilerin bileşimindeki farklardan kaynaklanır • Bir cam/kalomel sistemindeki elektrotlar standart bir tampona daldırıldığında p. H’nın tanımı: p. Hu= p. Hs-(Eu-Es)/0, 059 Eşitliği ile verilir.

• Burada, Es= standart tampon çözeltiye daldırıldığında hücre potansiyeli Eu: p. H sı bilinmeyen çözeltiye daldırıldığında, hücre potansiyeli. p. Hu: numune çözeltisinin p. H sı p. Hs= Standart tampon çözeltinin p. H sını gösterir.

• Örnek: Cam elektrot ünitesinde p. H sı 5. 0 olan standart bir tampon çözeltisi 0, 267 V luk bir potansiyel veriyor. Cam elektrot hidrojen iyonu derişimi bilinmeyen bir çözeltiye daldırıldığında 0, 275 V luk bir potansiyel ölçülüyor. Derişimi bilinmeyen çözeltinin p. H sını hesaplayınız.