CAPITOLO 2 LE MISURE DELLA TERRA Classi 1





















- Slides: 28

CAPITOLO 2: LE MISURE DELLA TERRA Classi 1 CL e 1 EL Libro - Le scienze naturali: osservare la terra e la materia CAPITOLO 2 - Da pagina 28 a 32. E da pagina 38 a 43 CAPITOLO 3 – Da pagina 54 a 71 A. Gentileschi anno 2016/2017 Email docente: borchetta. simone@gmail. com

1. Le grandezze intensive ed estensive Le grandezze che descrivono le proprietà della materia sono di due tipi: le grandezze estensive e le grandezze intensive. Le grandezze intensive non dipendono dalle dimensioni del corpo; le grandezze variano al variare delle dimensioni del corpo. Massa e volume sono grandezze estensive, la densità è intensiva.

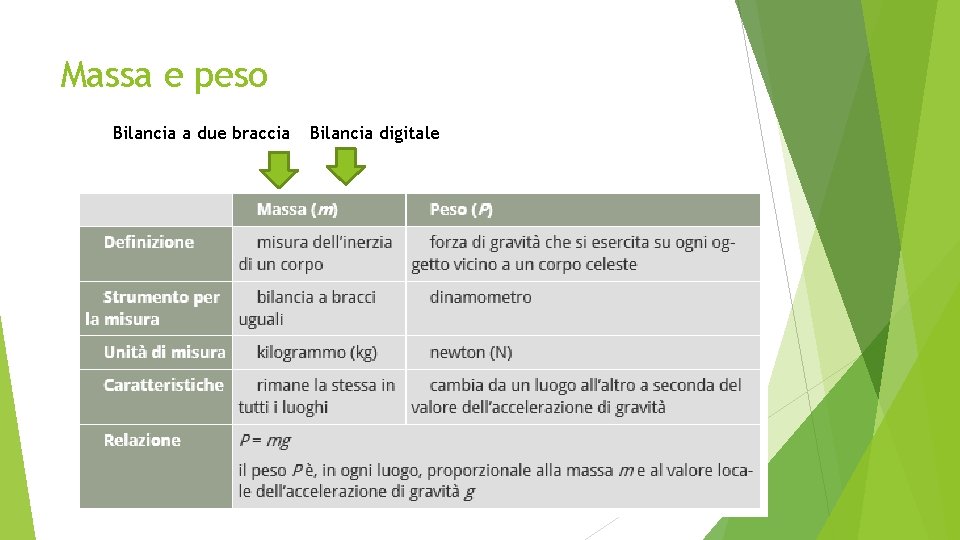
Massa. Come si misura ? La massa è la misura dell’inerzia di un corpo, cioè la misura della resistenza che il corpo oppone alla variazione del suo stato di quiete o di moto. l’unità di misura è il Kilogrammo (kg). La massa dipende solo dalla quantità di materia del corpo.

Massa e peso Bilancia a due braccia Bilancia digitale

IL Volume Il volume è una grandezza derivata della lunghezza Le misure di volume sono molto frequenti nel laboratorio di chimica e nella vita quotidiana (perlopiù si tratta di misure di liquidi). Il volume è una grandezza derivata da una lunghezza (V= l * l) e la sua unità di misura nel SI è il metro cubo, m 3. Per convertire in millilitri le misure espresse in decimetri cubi, o centimetri cubi, è necessario ricordare che: 1 m 3= 1000 dm 3= 1000000 cm 3 In questo caso bisogna spostarsi di tre posti quando si passa da un’unità di misura all’altra. 1 L = 10 -3 m 3 = 1 dm 3 = 1000 cm 3 = 1000 m. L Pertanto: 1 m. L = 1 cm 3 = 10 -3 dm 3

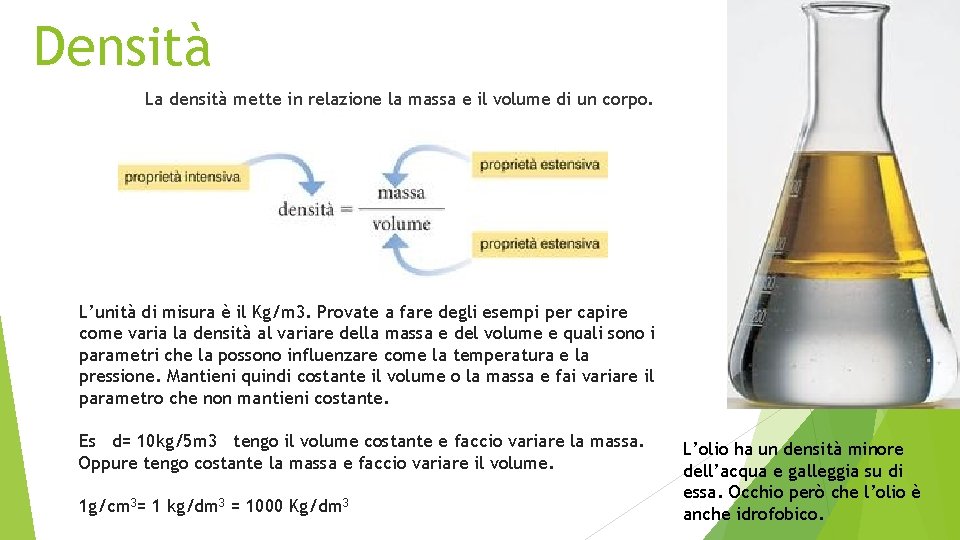
Densità La densità mette in relazione la massa e il volume di un corpo. L’unità di misura è il Kg/m 3. Provate a fare degli esempi per capire come varia la densità al variare della massa e del volume e quali sono i parametri che la possono influenzare come la temperatura e la pressione. Mantieni quindi costante il volume o la massa e fai variare il parametro che non mantieni costante. Es d= 10 kg/5 m 3 tengo il volume costante e faccio variare la massa. Oppure tengo costante la massa e faccio variare il volume. 1 g/cm 3= 1 kg/dm 3 = 1000 Kg/dm 3 L’olio ha un densità minore dell’acqua e galleggia su di essa. Occhio però che l’olio è anche idrofobico.

Densità La densità è determinata dalla composizione, ma può variare se cambiano temperatura e stato fisico. In generale la densità diminuisce quando passa dallo stato solido a quello liquido oppure da liquido ad aeriforme.

Le dimensioni della terra La Terra ha una forma complessa con densità nella litosfera e temperatura che variano se ci spostiamo da una parte all’altra dell’emisfero. Ad esempio al polo sud le temperature possono sfiorare i -90°C, mentre nella valle della morte sono stati raggiunti i +58°C. La temperatura media della Terra però è di +15°C. Questa temperatura garantisce la vita e l’acqua allo stato liquido. La retta che unisce il centro della Terra con un punto sulla superficie è detta raggio. Raggio equatoriale e raggio polare sono leggermente differenti in lunghezza. La Terra risulta quindi leggermente schiacciata ai poli. La Terra è un corpo celeste che ruota in senso antiorario intorno ad un asse immaginario, detto asse terrestre. Possiede massa e volume relativamente piccoli, mentre ha una densità elevata.

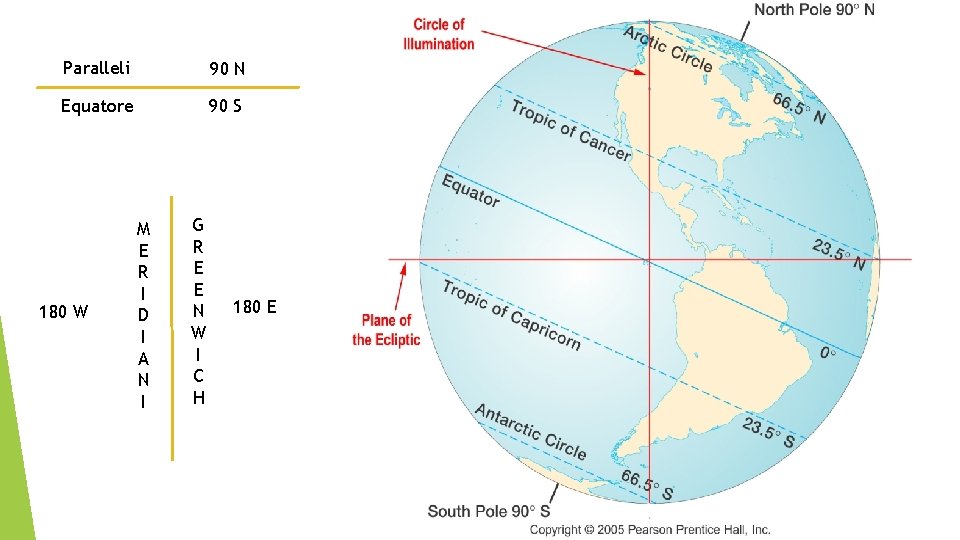
Paralleli 90 N Equatore 90 S 180 W M E R I D I A N I G R E E N W I C H 180 E

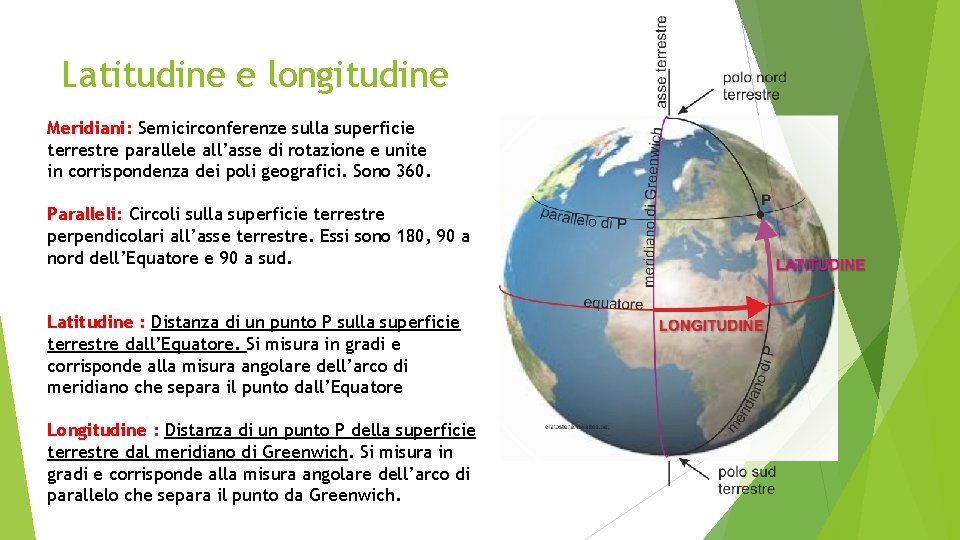
Latitudine e longitudine Meridiani: Semicirconferenze sulla superficie terrestre parallele all’asse di rotazione e unite in corrispondenza dei poli geografici. Sono 360. Paralleli: Circoli sulla superficie terrestre perpendicolari all’asse terrestre. Essi sono 180, 90 a nord dell’Equatore e 90 a sud. Latitudine : Distanza di un punto P sulla superficie terrestre dall’Equatore. Si misura in gradi e corrisponde alla misura angolare dell’arco di meridiano che separa il punto dall’Equatore Longitudine : Distanza di un punto P della superficie terrestre dal meridiano di Greenwich. Si misura in gradi e corrisponde alla misura angolare dell’arco di parallelo che separa il punto da Greenwich.

Il piano dell’orizzonte e punti cardinali I punti cardinali sono quattro. Nord – Sud – Ovest e Est Se ci rivolgiamo con il viso verso Nord. A destra avremo sempre l’Est, a sinistra l’Ovest e dietro il viso il Sud. Il sole sorge a Est e tramonta ad Ovest. Nell’immagine l’uomo è rivolto con il viso verso sud. In questo caso l’est si trova a sinistra, l’ovest e destra e il nord dietro il viso. Osservando il cielo di notte ci appare come una semisfera cava. La linea immaginaria, perpendicolare al piano dell’orizzonte e passante per l’osservatore è detta verticale del luogo. Quest’ultima interseca la sfera celeste in un punto posto sopra l’osservatore chiamato zenit.

CAPITOLO 3: I materiali della terra Classi 1 CL e 1 EL Libro - Le scienze naturali: osservare la terra e la materia CAPITOLO 3 - Da pagina 54 a 71 A. Gentileschi anno 2016/2017 Email docente: borchetta. simone@gmail. com

La materia e le sostanze I corpi e i sistemi della terra non sono differenti solo per dimensione, forma e peso, ma soprattutto per COMPOSIZIONE. La CHIMICA si occupa di identificarli, analizzarne le qualità a livello microscopico e particellare. Il chimico dovrà catalogare i materiali in base all’uniformità o disomogeneità della loro composizione. I materiali formati da un solo tipo di componente sono chiamate sostanze pure. Una sostanza pura può essere il ferro, l’acqua distillata, il magnesio. L’acqua di mare invece non è una sostanza pura. Infatti al suo interno contiene del sale. Ad ogni sostanza viene dato un nome che a volte a livello scientifico differisce da quello di tutti i giorni. Sale – Cloruro di sodio Zucchero. Saccarosio

Caratteristiche delle sostanze DUE CARATTERISTICHE FONDAMENTALI: Ogni sostanza presenta proprietà fisiche e chimiche ben definite che rimangono invariate indipendentemente dalle dimensioni o dalla provenienza del campione, come densità, temperatura di fusione ed ebollizione ecc. . Non esistono sostanze con identiche proprietà fisiche e chimiche. Possono sembrare simili, ma in realtà a livello microscopico non lo sono

Le proprietà fisiche delle sostanze A temperatura ambiente le sostanze non si presentano tutte nello stesso stato. Provata a pensare all’acqua, all’ossigeno o all’alluminio. A temperatura ambiente l’acqua e liquida, l’ossigeno è aeriforme, mentre l’alluminio è solido. Abbiamo studiato che gli stati non sono permanenti, ma possono essere variati modificando temperatura e pressione. Quando una sostanza subisce un cambiamento di stato, modifica sensibilmente il proprio aspetto, ma conserva inalterate le proprietà chimiche. A pressione costante ogni sostanza ha una propria temperatura di ebollizione e di fusione. Queste proprietà sono dette intensive, perché non dipendono dalla dimensione del campione e ne dalla massa e rimangono costanti durante i cambiamenti di stato

Miscugli eterogenei e miscugli omogenei In natura è difficile trovare sostanze allo stato puro. I materiali formati da due o più sostanze sono chiamati miscugli. I miscugli posso essere eterogeni o omogenei. Miscuglio eterogeneo: è costituito da due o più componenti che formano fasi distinte, diverse l’una dall’altra per proprietà riconoscibili a occhio nudo o con un microscopio. Si utilizza il termine fase per indicare una porzione di materia che ha caratteristiche proprie e delimitate da superfici di separazione definite. Granito (Quarzo- biotite – plagioclasio kfeldspato) Miscuglio omogeneo: è costituito da sostanze che si mescolano perfettamente, tanto da non essere più riconoscibili ad occhio nudo e nemmeno ricorrendo ai microscopi. Ad esempio l’acqua potabile. I miscugli omogeni sono chiamati soluzioni. Nelle soluzioni si riconosce un solvente ( quello che scioglie) e un soluto (ciò che è sciolto). Il solvente è la sostanza presente in maggior quantità, mentre il soluto è presente in minor quantità.

Miscugli omogenei ed eterogenei Nelle soluzioni liquide il solvente è un liquido, ma in esso possono essere disciolti gas, solidi o altri liquidi. Ogni solvente liquido ha la capacità di sciogliere solo alcune sostanze. Le soluzioni dove il solvente è l’acqua sono dette soluzioni acquose. La distinzione tra miscugli eterogenei ed omogenei non è sempre netta. Alcuni miscugli eterogenei possono sembrare omogenei se mescolati vigorosamente, ma l’effetto è solo temporaneo e con il tempo le componenti si separano e stratificano. Questi miscugli si chiamano sospensioni e si stratificano perché sono formati da particelle superiori a 1 micrometro. Esistono anche altri miscugli come i colloidi le cui particelle hanno dimensioni comprese tra 1 micrometro e 1 nanometro e presentano proprietà intermedie tra i miscugli eterogenei ed omogenei. Non stratificano e hanno proprietà particolari. I colloidi costituiti da particelle solide disperse in un mezzo fluido sono chiamati emulsioni.

Soluzioni o sostanze ? Spesso è difficile stabilire ad occhio nudo se un materiale che ci appare omogeneo è una soluzione oppure una sostanza. Per evitare confusione è utile sapere che le soluzioni possiedono due caratteristiche: Le soluzioni non hanno proprietà costanti perché le loro componenti possono essere mescolate in proporzioni diverse da caso. Molte proprietà fisiche dipendono quindi non solo dal tipo di sostanze contenute, ma anche dalle loro quantità relative. (Es acqua salata) Nelle soluzioni le sostanze sono mescolate, ma non perdono la propria identità, perciò possono essere separate utilizzando procedimenti fisici. La separazione dei componenti di una soluzione è più complessa rispetto a un miscuglio eterogeneo perché ogni volume di soluzione ha proprietà identiche agli altri (Es. gravità e sedimentazione)

Comportamento diverso Poiché le soluzioni possono avere composizione variabile, è fondamentale indicare sia le sostanze presenti sia la loro concentrazione, che esprime il rapporto tra quantità di soluto e quantità di solvente. Una soluzione è molto concentrata quando la quantità di soluto in rapporto alla quantità totale di soluzione o di solvente è elevata. Al contrario una soluzione si dice diluita quando il rapporto tra soluto e soluzione è piccolo. Le soluzioni, al contrario delle sostanze, non hanno proprietà costanti

La reattività della sostanza Abbiamo visto che le sostanze non cambiano identità nei processi fisici. Esistono tuttavia trasformazioni che producono cambiamenti profondi nelle sostanze. Questo avviene tramite una reazione chimica. Una REAZIONE CHIMICA è un processo in cui le sostanze presenti inizialmente si trasformano in sostanze diverse. REAGENTI PRODOTTI Le sostanze presenti all’inizio di una reazione chimica sono detti reagenti Le sostanze che si trovano alla fine di una reazione chimica sono detti prodotti

Reazioni chimiche Spesso le reazioni sono accompagnate da fenomeni caratteristici che aiutano a riconoscerle, come la scomparsa o la formazione di un solido, il cambiamento di colore e/o aspetto fisico, la formazione di gas, lo sviluppo di calore o l’emissione di luce Le reazioni sono trasformazioni della materia in cui si formano sostanze (prodotti) diverse da quelle di partenza (reagenti). Vengono rappresentate mediante equazioni chimiche. Reagenti -> prodotti

Legge di conservazione della massa, legge di Proust e principio di conservazione dell’energia. MASSA - La legge di conservazione della massa afferma che la somma delle masse dei reagenti consumati in una reazione è uguale alla somma delle masse dei prodotti ottenuti. E’ valida in un sistema chiuso. ENERGIA - Nelle reazioni l’energia non si crea e non si distrugge, ma si può trasformare. Le reazioni esoergoniche producono sostanze con minore energia chimica potenziale dei prodotti, al contrario di quelle endoergoniche. PROUST – Secondo la legge di Proust, in un composto gli elementi sono sempre combinati in rapporti di massa definiti e costanti. Il rapporto è diverso da composto. [Esempio biciclette]

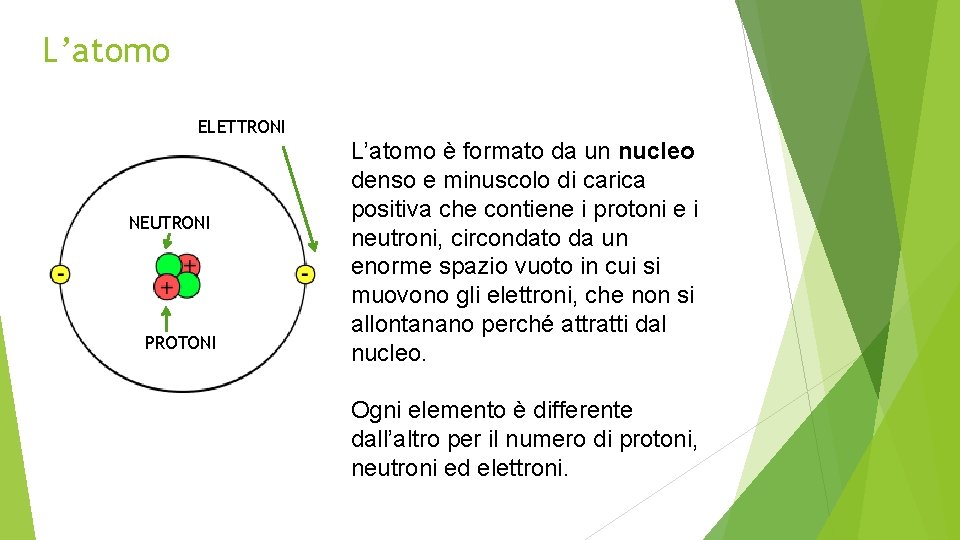
L’atomo ELETTRONI NEUTRONI PROTONI L’atomo è formato da un nucleo denso e minuscolo di carica positiva che contiene i protoni e i neutroni, circondato da un enorme spazio vuoto in cui si muovono gli elettroni, che non si allontanano perché attratti dal nucleo. Ogni elemento è differente dall’altro per il numero di protoni, neutroni ed elettroni.

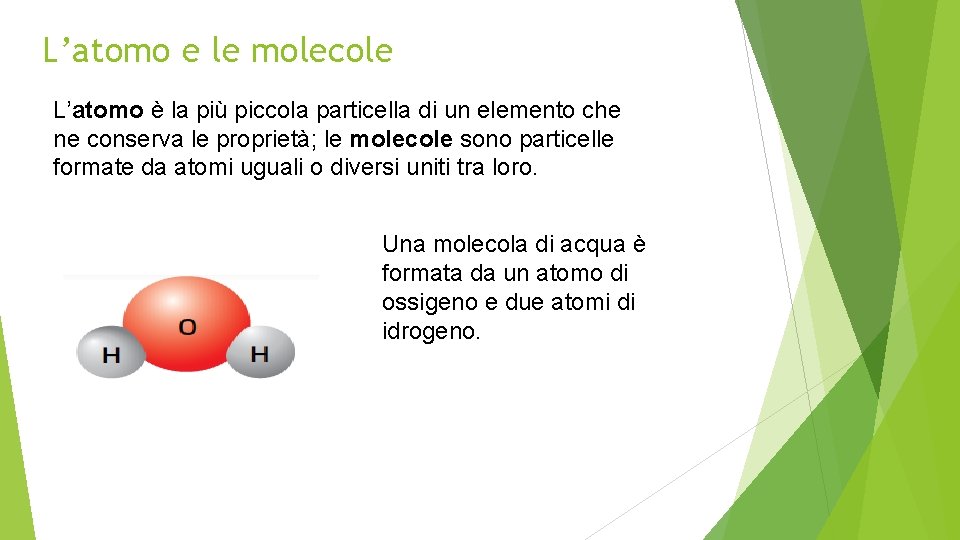
L’atomo e le molecole L’atomo è la più piccola particella di un elemento che ne conserva le proprietà; le molecole sono particelle formate da atomi uguali o diversi uniti tra loro. Una molecola di acqua è formata da un atomo di ossigeno e due atomi di idrogeno.

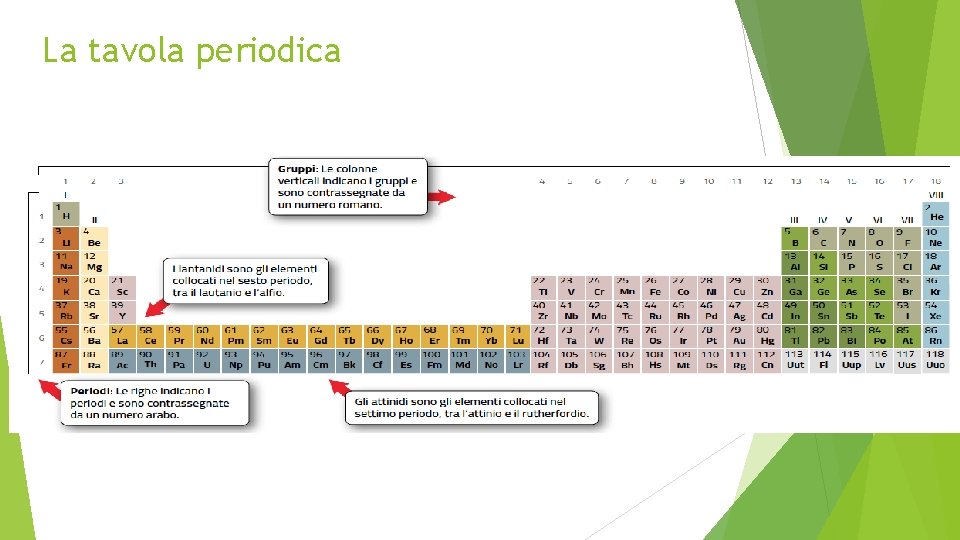
La tavola periodica

Metalli, non metalli e semimetalli Nella tavola periodica, i 118 elementi sono divisi in tre categorie: metalli, non metalli e semimetalli. I metalli conducono calore ed elettricità, sono duttili, malleabili e deformabili; i non metalli hanno proprietà variabili; i semimetalli hanno proprietà intermedie.

BUONO STUDIO RAGAZZI

http: //meteosedriano. altervista. org/gent