Autor vukovho materilu Petra Majerkov Datum vytvoen vukovho









- Slides: 10

Autor výukového materiálu: Petra Majerčáková Datum vytvoření výukového materiálu: květen 2013 Ročník, pro který je výukový materiál určen: VIII Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Tématický okruh: Anorganická chemie Téma: p. H, indikátory Anotace: Prezentace slouží žákům jako osnova probíraného učiva. Obsahuje základní údaje k tématu – kyselé, zásadité, neutrální prostředí, indikátor, stupnice p. H, užití. Text slouží i jako zápis do sešitu. Autorem materiálu a všech jeho částí, není-li uvedeno jinak, je Petra Majerčáková. Tvorba materiálu je financována z ESF a státního rozpočtu ČR.

p. H, indikátory

• Kyselost roztoku způsobují vodíkové kationty H+ • Zásaditost roztoku způsobují hydroxidové anionty OH-. • Voda obsahuje stejné množství H+ a OH- - říkáme, že je neutrální. • Přidáním kyseliny převládne počet H+ (kyselý roztok) • Přidáním hydroxidu převládne počet OH- (zásaditý roztok) • K přesnému vyjádření koncentrace vodíkových iontů slouží stupnice p. H. • K určení hodnot p. H používáme indikátory.

INDIKÁTORY • Látky, které mění barvu v závislosti na prostředí. • Mohou být přírodní (lakmus) nebo vyrobené (fenolftalein). • Některé lze vyrobit doma (šťáva z borůvek nebo červeného zelí), jiné zakoupit v drogerii.

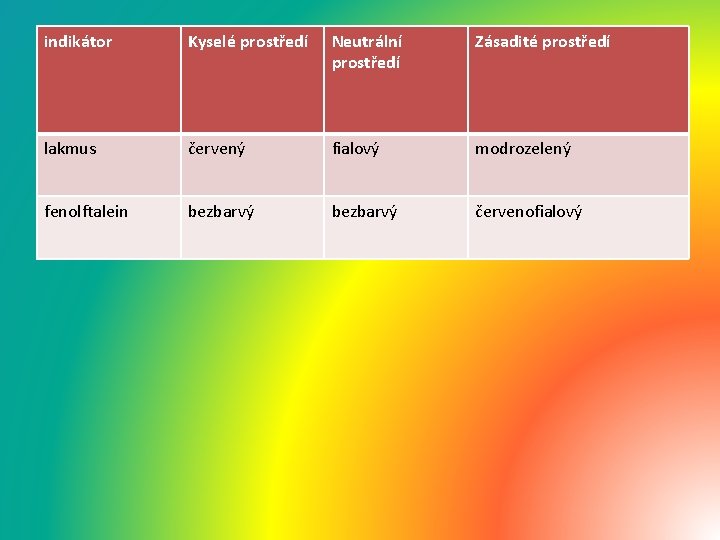
• indikátor Kyselé prostředí Neutrální prostředí Zásadité prostředí lakmus červený fialový modrozelený fenolftalein bezbarvý červenofialový

• Míru kyselosti určuje stupnice p. H: 0 -14. Podle hodnoty rozdělujeme roztoky na: • kyselé: p. H ‹ 7 (čím je hodnota nižší, tím je roztok kyselejší) • neutrální: p. H = 7 • zásadité: p. H › 7 (čím je hodnota vyšší, tím je zásaditější

Přibližné hodnoty p. H různých látek • kyselina v autobateriích: p. H = 1 • žaludeční kyselina: p. H = 2 • šťáva z citronu: p. H = 2 • Coca – cola: p. H = 2 • ocet: p. H = 3 • šťáva z pomeranče nebo jablka: p. H = 3 • pivo: p. H = 4 • káva: p. H = 5 • čaj: p. H = 5

• • • kyselý déšť: p. H = 6 mléko: p. H = 6 destilovaná voda: p. H = 7 sliny zdravého člověka: p. H = 6 - 7 krev: p. H = 7 mořská voda: p. H = 8 pevné toaletní mýdlo: p. H = 9 - 10 hydroxid amonný: p. H = 11 hašené vápno: p. H = 12 hydroxid sodný: p. H = 13

Užití indikátorů v praxi: • zemědělství – určování kyselosti půd • vodárenství – při čištění odpadních vod • lékařství a farmacie (výroba léků) • potravinářství – určení kyselosti potravin • chemický průmysl

• Zdroje: VACÍK, Jiří. Přehled středoškolské chemie. 1. vyd. Praha: SPN, 1995, 365 s. ISBN 80 -859 -3708 -5. BENEŠ, Pavel, Václav PUMPR a Jiří BANÝR. Základy chemie pro 2. stupeň základní školy, nižší ročníky víceletých gymnázií a střední školy: úvod do obecné a anorganické chemie. 3. vyd. Praha: Fortuna, 2000, 143 s. Duhová řada, sv. 93. ISBN 80 -716 -8720 -0