Autor vukovho materilu Petra Majerkov Datum vytvoen vukovho














- Slides: 14

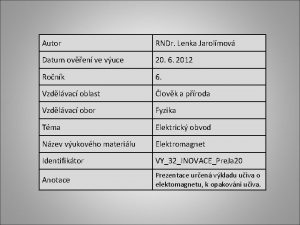
Autor výukového materiálu: Petra Majerčáková Datum vytvoření výukového materiálu: duben 2013 Ročník, pro který je výukový materiál určen: VIII Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Tématický okruh: Anorganická chemie Téma: OXIDY Anotace: Prezentace slouží žákům jako osnova probíraného učiva. Obsahuje základní údaje k tématu – dělení oxidů, jejich vlastnosti a užití. K prezentaci je možnost využít i pracovní list. Text slouží i jako zápis do sešitu. Autorem materiálu a všech jeho částí, není-li uvedeno jinak, je Petra Majerčáková. Tvorba materiálu je financována z ESF a státního rozpočtu ČR.

OXIDY

• Oxidy jsou dvouprvkové sloučeniny kyslíku a dalšího prvku. Rozdělují se na: • kyselinotvorné • zásadotvorné • amfoterní

• Kyselinotvorné oxidy při reakci s vodou vytváří kyseliny. Mezi kyselinotvorné oxidy patří: • oxid uhličitý • oxid siřičitý

Oxid uhličitý CO 2 Vlastnosti • bezbarvý nedýchatelný plyn • součástí vzduchu (těžší než vzduch) Užití • v chladících zařízení • k výrobě sody, sodové vody • k plnění hasících přístrojů http: //www. youtube. com/watch? v=Y 9 XLe. Br. Bs Wk – koloběh oxidu uhličitého

Dopiš rovnice a pojmenuj látky: • Reakce dokonalého spalování • Reakce nedokonalého spalování

Oxid siřičitý SO 2 Vlastnosti • bezbarvý ostře zapáchající plyn (dráždí ke kašli) • toxický Užití • výroba celulózy a papíru ze dřeva, • k bělení vlny, bavlny • k dezinfekci (síření) sudů, sklepů, včelích úlů

• Kyselé deště V ovzduší silně znečištěném některými druhy škodlivin, jako jsou oxid siřičitý nebo oxidy dusíku, dochází chemickými reakcemi s vodní párou ke vzniku slabých kyselin. Ty spolu s deštěm a sněžením padají na zemský povrch a mluvíme o nich jako o kyselých deštích. Kyselé deště mají velmi nepříznivý vliv především na půdu a rostliny, zejména některé druhy stromů. Když bylo v naší republice v 70. a 80. letech 20. století ovzduší nejvíce znečištěné, způsobily kyselé deště odumření celých rozsáhlých lesů na hřebenech Krušných a Jizerských hor. Mohlo za to znečištění z tepláren a elektráren spalujících uhlí.

• Skleníkový efekt je proces, při kterém atmosféra způsobuje ohřívání planety tím, že snadno propouští sluneční záření, ale tepelné záření o větších vlnových délkách zpětně vyzařované z povrchu planety účinně absorbuje a brání tak jeho okamžitému úniku do prostoru. • Vodní páry (H 2 O) způsobují asi 60 % zemského přirozeného skleníkového efektu. Ostatní plyny ovlivňující tento efekt jsou oxid uhličitý (CO 2) (kolem 26 %), methan (CH 4), oxid dusný (N 2 O) a ozón (O 3) (asi 8 %).

Oxid vápenatý Ca. O = pálené vápno Vlastnosti • bílá žiravá krystalická látka Užití • součást sádry a malty • v zemědělství a lesnictví - snižuje kyselost půdy Býval používán při pohřbívání mrtvých těl do otevřených hrobů zvláště v období epidemií například moru za účelem dezinfekce a zamezení zápachu rozkladu.

Dopiš rovnice a pojmenuj látky: • Reakce vzniku páleného vápna (oxid vápenatý) • Reakcí páleného vápna s vodou vzniká hašené vápno (hydroxid vápenatý)

Oxid hlinitý Al 2 O 3 • V přírodě se vyskytuje jako nerost korund. Jeho odrůdy jsou smirek a drahé kameny – safír (modrá barva) a rubín (červená barva). Užití: • smirek – brusný materiál – brusný papír a brousky • bauxit – výroba hliníku • safír a rubín - šperkařství

Oxid křemičitý Si. O 2 Vlastnosti • pevná těžko tavitelná látka Užití • sklářský a keramický průmysl • křemenné sklo – výroba laboratorních pomůcek • silikagel – sušidlo

Zdroje: • BENEŠ, Pavel, Václav PUMPR a Jiří BANÝR. Základy chemie pro 2. stupeň základní školy, nižší ročníky víceletých gymnázií a střední školy: úvod do obecné a anorganické chemie. 3. vyd. Praha: Fortuna, 2000, 143 s. Duhová řada, sv. 93. ISBN 80 -716 -8720 -0 • VACÍK, Jiří. Přehled středoškolské chemie. 1. vyd. Praha: SPN, 1995, 365 s. ISBN 80 -8593708 -5.
 Citar en formato apa
Citar en formato apa Ejemplo formato apa libro
Ejemplo formato apa libro Statistical investigations unit 3 section a
Statistical investigations unit 3 section a Datum point forensics
Datum point forensics Banska
Banska Data merupakan bentuk jamak dari
Data merupakan bentuk jamak dari 800 n
800 n Datum plaats brief
Datum plaats brief Oven datum
Oven datum Sv lucija datum
Sv lucija datum Datum dimensioning method
Datum dimensioning method Datum
Datum Types of datum used in marking out
Types of datum used in marking out Ort och datum exempel
Ort och datum exempel Mit wirkung vom datum
Mit wirkung vom datum